
| A、Ag和AgCl溶液 |
| B、Ag和AgNO3溶液 |
| C、Pt和Ag2CO3溶液 |
| D、Pt和Ag2SO4溶液 |
科目:高中化学 来源: 题型:
| A、气体的摩尔体积约为22.4L?mol-1 |
| B、1 mol H2的质量是2g,它所占的体积约是22.4L?mol-1 |
| C、在标准状况下,1 mol任何物质所占的体积都约为22.4L?mol-1 |
| D、在标准状况下,1 mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
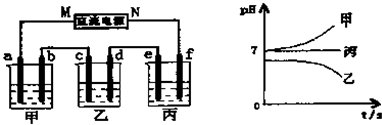
 装置如图:D是盐桥,E是稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯.
装置如图:D是盐桥,E是稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:
 |  | 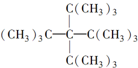 | … |
| 1 | 2 | 3 | … |
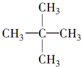
| A、C53H108 |
| B、C36H72 |
| C、C53H106 |
| D、C36H70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处.
(1)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | |
| 浓度1 | 0.05mol?L-1 | a mol?L-1 | 0.05 mol?L-1 |
| 浓度2 | 0.078 mol?L-1 | 0.078 mol?L-1 | 0.122 mol?L-1 |
| 浓度3 | 0.06 mol?L-1 | 0.06 mol?L-1 | 0.04 mol?L-1 |
| 浓度4 | 0.07 mol?L-1 | 0.07 mol?L-1 | 0.098 mol?L-1 |
| A、由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应 |
| B、由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度 |
| C、[浓度1]中a=0.05 |
| D、该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com