
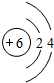 ,B与C形成的化合物的电子式为
,B与C形成的化合物的电子式为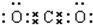 .
.分析 A、B、C、D分别代表四种不同的短周期元素;A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;当n=2时,A为Li,处于第二周期第ⅠA族,B为碳元素;当n=3时,A为Na、B为Si元素;
C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P能级中有3个电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素,据此解答各小题.
解答 解:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P能级中有3个电子,则D元素原子电子排布式为1s22s22p6 3s23p3,故D为P元素,
(1)氧原子核外电子数为8,核外电子排布为1s22s22p4;若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键,属于σ键,
故答案为:1s22s22p4;σ;
(2)当n=2时,A为Li,处于第二周期第ⅠA族,属于ss区元素;B为碳元素,碳原子的原子序数为6,其原子结构示意图为: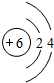 ;C与O形成的化合物为为二氧化碳,属于共价化合物,其电子式为:
;C与O形成的化合物为为二氧化碳,属于共价化合物,其电子式为: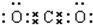 ,
,
故答案为:第二周期第ⅠA族;s;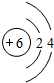 ;
;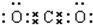 ;
;
(3)当n=3时,A、为Na、B为Si元素,Si与O形成二氧化硅,二氧化硅为原子晶体,微粒之间的作用力为共价键;同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,故第一电离能O>P>Si>Na,
故答案为:共价键;O>P>Si>Na.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,涉及电子式、第一电离能、电子排布式、晶体类型等知识,正确推断各元素为解答关键,注意熟练掌握元素周期表结构、元素周期律内容.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
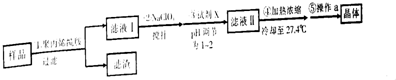
| A. | 步骤①中过滤操作需用到的玻璃仪器为玻璃棒、分液漏斗、烧杯 | |
| B. | 步骤②中搅拌操作可加快散热,减少FeCl3水解 | |
| C. | 步骤③中加入的试剂X为浓盐酸 | |
| D. | 步骤⑤中操作a为过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 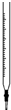 图为碱式滴定管,可盛装NaOH、KMnO4等溶液,不可盛装酸性液体 | |
| B. | 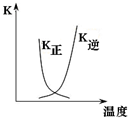 图中曲线表示反应2A(g)+B(g)═2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 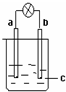 图中如果a是铁,b是碳,c是氯化铜溶液,则电流计指针偏转,且a变粗,b变细 | |
| D. | 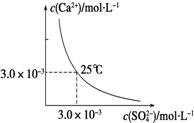 图表示25℃时,CaSO4在水中的沉淀溶解平衡曲线.向100 mL该条件下的CaSO4饱和溶液中加入100 mL 0.01mol•L-1的Na2SO4溶液有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是氧化剂 | B. | 是还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21:12:4 | B. | 5:5:4 | C. | 5:5:1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
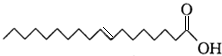 ,下列判断不正确的是( )
,下列判断不正确的是( )| A. | 该物质与丙烯酸互为同系物 | |
| B. | 该物质的分子式为C18H34O2 | |
| C. | 该物质易溶于水,在空气中不易变质 | |
| D. | 该物质的碳链含有锯齿形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定溶液pH的操作:将pH试纸置于表面皿上,用蒸馏水润湿,再用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量 | |
| D. | 做Al与CuSO4溶液的置换反应实验时,可将铝条直接插入CuSO4溶液中,观察铝片表面是否有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
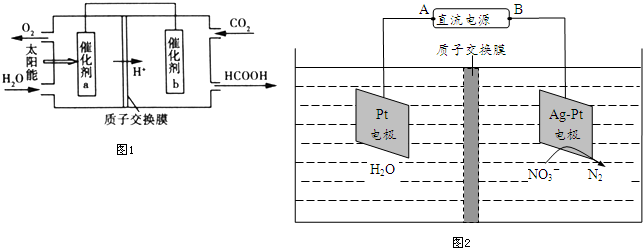
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
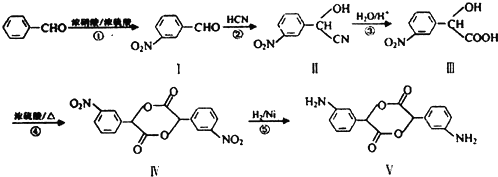
 和
和 .
.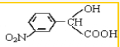 →
→ +H2O(不要求写出反应条件);用丙酮(
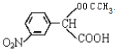
+H2O(不要求写出反应条件);用丙酮( 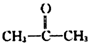 )代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.
)代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.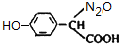 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com