
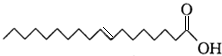
 ,下列判断不正确的是( )
,下列判断不正确的是( )| A. | 该物质与丙烯酸互为同系物 | |
| B. | 该物质的分子式为C18H34O2 | |
| C. | 该物质易溶于水,在空气中不易变质 | |
| D. | 该物质的碳链含有锯齿形结构 |
分析 该物质中含有碳碳双键和羧基,所以具有烯烃和羧酸的性质,能发生加成反应、加聚反应、氧化反应、取代反应、酯化反应、中和反应,据此分析解答.
解答 解:A.丙烯酸结构简式为CH2=CHCOOH,该物质结构和丙烯酸相似,比丙烯酸多15个-CH2原子团,所以与丙烯酸是同系物,故A正确;
B.根据结构简式知,分子式为C18H34O2,故B正确;
C.亲水基相对分子质量较小,所以该物质难溶于水,含不饱和键,在空气中易被氧化,故C错误;
D.根据键线式知,该物质的碳链含有锯齿形结构,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查基本概念、物质性质和结构关系,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | 用聚乳酸塑料代替聚乙烯塑料可减少白色污染 | |
| B. | 煤油、“乙醇汽油”、“生物柴油”都是碳氢化合物 | |
| C. | 为防治碘缺乏病,在食用盐中添加适量的碘酸钾 | |
| D. | 甘油可用作护肤保湿剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
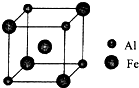 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②⑥ | C. | ⑤⑦ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
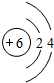 ,B与C形成的化合物的电子式为
,B与C形成的化合物的电子式为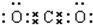 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
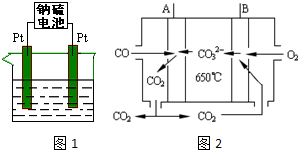
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
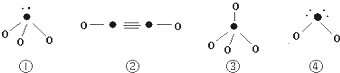
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com