
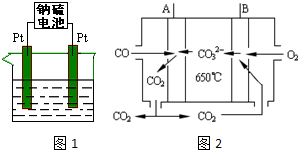
���� ��1���ٸ��ݵ�ط�Ӧʽ֪�����ʱ�������ӵõ��ӷ�����ԭ��Ӧ����������������Ӧ�����ӵ�Դ������������ʧ���ӷ���������Ӧ��
�ڷŵ�ʱ��S�õ��ӷ�����ԭ��Ӧ��������������23gʱ�������ʵ���Ϊ1mol��ÿ����ԭ��ʧȥһ�����ӣ�����ʧ�������ʵ���Ϊ1mol�������������������ӷŵ���������������ת�Ƶ����غ��0.2mol�����ӷŵ磬ͬʱ��0.8mol���������ӷŵ磻��������0.2molͭ���ӷŵ�����Cu��ͭ���ӵõ������ʵ�����0.4mol������0.6mol�����ӷŵ磬ʵ�����൱����0.6molˮ������⣬����������0.2mol���������ӷŵ磬����������0.2mol���������ɣ�
��2��ȼ�ϵ���У�ȼ��������������������������ȼ�ϵ����A�Ǹ�����B��������������COʧ���ӷ���������Ӧ��
��� �⣺��1���ٸ��ݵ�ط�Ӧʽ֪�����ʱ�������ӵõ��ӷ�����ԭ��Ӧ����������������Ӧ�����ӵ�Դ������������ʧ���ӷ���������Ӧ���缫��ӦʽΪNa2Sx-2e-=xS+2Na+ ��Sx2--2e-=xS��
�ʴ�Ϊ������Na2Sx-2e-=xS+2Na+ ��Sx2--2e-=xS��
�ڷŵ�ʱ��S�õ��ӷ�����ԭ��Ӧ��������������23gʱ�������ʵ���Ϊ1mol��ÿ����ԭ��ʧȥһ�����ӣ�����ʧ�������ʵ���Ϊ1mol�������������������ӷŵ���������������ת�Ƶ����غ��0.2mol�����ӷŵ磬ͬʱ��0.8mol���������ӷŵ磻��������0.2molͭ���ӷŵ�����Cu��ͭ���ӵõ������ʵ�����0.4mol������0.6mol�����ӷŵ磬ʵ�����൱����0.6molˮ������⣬����������0.2mol���������ӷŵ磬����������0.2mol���������ɣ�������Ũ��=$\frac{0.2mol}{2L}$=0.1mol/L����Һ��pH=1��
�ʴ�Ϊ���������pH=1��
��2��ȼ�ϵ���У�ȼ��������������������������ȼ�ϵ����A�Ǹ�����B��������������COʧ���ӷ���������Ӧ���缫��ӦʽΪCO-2e-+CO32-=2CO2���ʴ�Ϊ��CO-2e-+CO32-=2CO2��
���� ���⿼�黯ѧ��Դ���͵�أ�Ϊ��Ƶ���㣬��ȷ�����缫�����ķ�Ӧ�ǽⱾ��ؼ����ѵ��ǵ缫��Ӧʽ����д��ע�⣨2���и����缫�����ӷŵ�˳����Ŀ�ѶȲ���


 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���������� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� | �� |
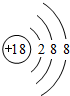 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
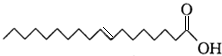 �������жϲ���ȷ���ǣ�������
�������жϲ���ȷ���ǣ�������| A�� | ���������ϩ�ụΪͬϵ�� | |
| B�� | �����ʵķ���ʽΪC18H34O2 | |
| C�� | ������������ˮ���ڿ����в��ױ��� | |
| D�� | �����ʵ�̼�����о���νṹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
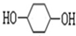 ��·��������ʾ���밴Ҫ������
��·��������ʾ���밴Ҫ������
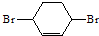 ��
��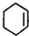 ��F
��F ��
��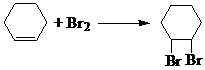 ����
����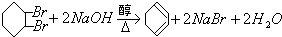 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
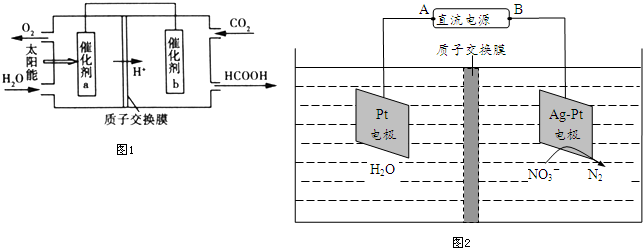
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.5 L 2 mol•L-1 AlCl3��Һ�У�Al3+��Cl-����С��4��6.02��1023�� | |
| B�� | �Ƴ�0.5 L 10 mol•L-1�����ᣬ��Ҫ��״���µ��Ȼ�������112 L | |
| C�� | ��1 L 1 mol•L-1��NaCl��Һ����ȡ��10 mL��Һ����Ũ����1 mol•L-1 | |
| D�� | 10 g 98%�����ᣨ�ܶ�Ϊ1.84 g•cm-3����10 mL18.4 mol•L-1�������Ũ�Ȳ�ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
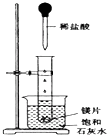 ��ͼ��ʾ�����Թܷ���ʢ��25��ı���ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���5mL�������Թ��У��Իش����лش�
��ͼ��ʾ�����Թܷ���ʢ��25��ı���ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���5mL�������Թ��У��Իش����лش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
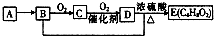 ��֪���л�������Aֻ��C��H����Ԫ���������ʹ��ˮ��ɫ�������������������һ������ʯ�ͻ�����չˮƽ��A��B��C��D��E����ͼת����ϵ�������ƶϴ�����ǣ�������
��֪���л�������Aֻ��C��H����Ԫ���������ʹ��ˮ��ɫ�������������������һ������ʯ�ͻ�����չˮƽ��A��B��C��D��E����ͼת����ϵ�������ƶϴ�����ǣ�������| A�� | ����A�ͼ����ѡ��ʹ�����Ը��������Һ | |
| B�� | D�к����Ȼ�������D���ʿ������ˮ���е�ˮ�� | |
| C�� | ͼ���漰�ķ�Ӧ�����мӳɡ�ȡ�������� | |
| D�� | B+D��E�Ļ�ѧ����ʽ��C2H5OH+CH3COOH��CH3COOC2H5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
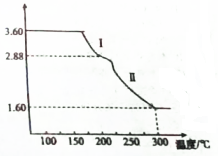 �ȼ��仯���������������������Ź㷺����;���ش��������⣺
�ȼ��仯���������������������Ź㷺����;���ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com