
【题目】不粘锅的内壁有聚四氟乙烯涂层,下列关于聚四氟乙烯的说法正确的是( )
A. 聚四氟乙烯的单体是不饱和烃
B. 聚四氟乙烯比较稳定
C. 聚四氟乙烯中氟的质量分数是73.1%
D. 聚四氟乙烯分子中含有双键
科目:高中化学 来源: 题型:
【题目】“清肺排毒汤”对新冠肺炎病毒感染具有良好的效果,其中一味中药黄芩的一种活性中间体的结构为: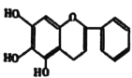 ,现在可人工合成,路线如图所示:
,现在可人工合成,路线如图所示:
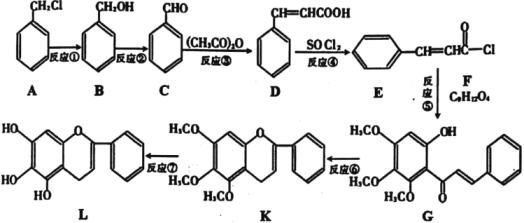
(1)A生成B的反应条件是___,B生成C的反应条件为___。
(2)合成过程中,属于取代反应的是___。
(3)F的结构简式为___。
(4)D在一定条件下能生成高分子化合物,请写出该反应的化学方程式___。同时符合下列三个条件的D的同分异构体共有___种。
a.能发生银镜反应;
b.苯环上有3个取代基;
c.与FeCl3溶液发生显色反应。
(5)依据以上合成信息,以乙烯和氯苯为原料合成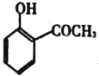 路线,无机试剂自选___。
路线,无机试剂自选___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
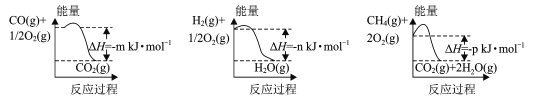
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 ___________。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
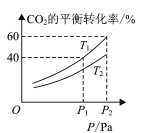
①反应过程中,表明反应达到平衡状态的标志是______;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 ___T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___(不必化简,可以不带单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修3——物质结构与性质] 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)在Y的最高价氧化物分子中,Y原子轨道的杂化类型是_______________。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_______________________;Z的氢化物在固态时的密度比在液态时还小,其原因是_________
(3)Y与Z可形成YZ42-。
①YZ42-的空间构型为________________(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:_________________。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的
数目为_______。
(5)X与Y所形成化合物晶体的晶胞如图所:
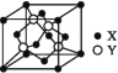
①在该晶体中,X离子的配位数为__________,与Y距离最近且距离相等的Y原子的数目为________。
②该晶胞的边长为a cm,该晶体的密度为__________________ g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g)![]() 2NO2(g) △H= —112 kJ·mol-1
2NO2(g) △H= —112 kJ·mol-1
2SO2(g)+ O2 (g) ![]() 2SO3(g) △H= —196 kJ·mol-1
2SO3(g) △H= —196 kJ·mol-1
SO2通常被NO2进一步氧化,生成SO3和一种无色有毒的气体。请写出NO2和SO2反应的热化学方程式______________。
(2) 常温下,烟气中SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________(写出主要反应的离子方程式),该溶液中c(Na+)____ 2c(SO32-)+ c(HSO3-)(填“>”“<”或“=”)。
②常温下,0.1mol/L的NaHSO3溶液的PH=6,则c(SO32-)—c(H2SO3)= ______ mol/L(填写准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析化学中,“滴定分数”的定义为:所加滴定剂与被滴定组分的物质的量之比。以0.10mol·L-1的NaOH溶液滴定同浓度某一元酸HA并绘制滴定曲线如图所示。已知lg3=0.5。下列说法中不正确的是( )
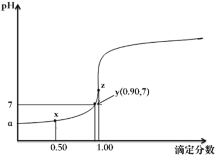
A.该酸碱中和滴定过程应选择酚酞做指示剂
B.根据y点坐标可以算得a的数值为3.5
C.从x点到z点,溶液中水的电离程度逐渐增大
D.x点处的溶液中满足:c(HA)+c(H+)>c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mLFeCl3与HCl的混合溶液中,分别加入一定量成分均匀的Fe、Cu混合固体,充分反应后剩余固体的质量及放出气体的体积(标准状况下测得)如下表所示。
加入固体质量/g | 9.00 | 18.0 | 27.0 |
剩余固体质量/g | 3.20 | 9.60 | 15.8 |
放出气体体积/L | 0 | 1.12 | 2.24 |
试计算:
(1)原混合液中c(Cl-)=____。
(2)混合固体中n(Fe):n(Cu)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻甲基苯甲酸主要用于农药、医药及有机化工原料的合成,其结构简式为 ,下列关于该物质的说法正确的是( )。
,下列关于该物质的说法正确的是( )。
A.该物质能与溴水生成白色沉淀
B.该物质含苯环的同分异构体中能水解且含有甲基的共5种
C.1mol该物质最多能与4molH2生加成反应
D.该物质中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香脂I(![]() )是一种重要的香料,工业上合成它的一种路线如下图所示。其中A的结构简式为
)是一种重要的香料,工业上合成它的一种路线如下图所示。其中A的结构简式为![]() ,C是能使溴的CCl4溶液褪色的烃,F是分子中含有一个氧原子的烃的衍生物。
,C是能使溴的CCl4溶液褪色的烃,F是分子中含有一个氧原子的烃的衍生物。

已知:①![]() ;
;
②酯环化合物:分子中含有3个及以上碳原子连接成的碳环,环内两个相邻碳原子之间可以是单键、双键或三键,环的数目可以是一个或多个。
(1)F的相对分子质量大于X,则F的名称为___________,X的结构简式为____________,C→D的另一种产物是HCl,则该反应的反应类型为_________________。
(2)从官能团角度上看,A属于_______物质,能将A、B区别开的试剂是_______,I中的官能团名称为________________________。
(3)写出D→E的化学方程式:_______________________________________________。
(4)B还有多种同分异构体,满足下列条件的同分异构体共有________种(不考虑立体异
构),其中核磁共振氢谱有4组峰,且峰面积之比为1:1: 2: 6的物质的结构简式为_______(任写一种)。
①能发生酯化反应 ②属于脂环化合物
(5)已知:CH3CH2OH+HNO3![]() CH3CH2ON2O(硝酸乙酯)+H2O。请写出以CH2ClCH=CH2为基本原料合成三硝酸甘油酯的合成路线图(无机试剂任选):______________________。
CH3CH2ON2O(硝酸乙酯)+H2O。请写出以CH2ClCH=CH2为基本原料合成三硝酸甘油酯的合成路线图(无机试剂任选):______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com