
【题目】向200mLFeCl3与HCl的混合溶液中,分别加入一定量成分均匀的Fe、Cu混合固体,充分反应后剩余固体的质量及放出气体的体积(标准状况下测得)如下表所示。
加入固体质量/g | 9.00 | 18.0 | 27.0 |
剩余固体质量/g | 3.20 | 9.60 | 15.8 |
放出气体体积/L | 0 | 1.12 | 2.24 |
试计算:
(1)原混合液中c(Cl-)=____。
(2)混合固体中n(Fe):n(Cu)=____。
【答案】4.00mol·L-1 1:1
【解析】
对比三组数据可知,当加入固体的质量为18g时,剩余的9.6g固体全部是铜,由此可计算n(Fe):n(Cu)为1:1;当加入固体的质量为27g时,由铁和铜的比例关系可判断剩余的15.8g固体的成分,由此可判断的铁与溶液中的铁离子和氢离子全部反应完全,可计算氯化铁和氯化氢的物质的量,即可求氯离子的物质的量浓度了。
(1)由分析知铁和铜的物质的量之比为1:1,当加入固体的质量为27g时,27g固体中有n(Fe)=n(Cu)=0.225mol,剩余固体中有14.4g铜,有1.4g的铁,则有0.2mol的铁与溶液中的铁离子和氢离子全部反应完全,由生成的氢气的体积可知,n(HCl)= 2n(H2)=0.2mol,与盐酸反应的铁的物质的量为n(Fe)= 0.1mol,与溶液中FeCl3反应的铁的物质的量为n(Fe)=0.2mol-0.1mol=0.1mol,则n(FeCl3)=0.2mol,溶液中的氯离子的浓度为c(Cl-)= ![]() ,故答案为:4.00mol·L-1;
,故答案为:4.00mol·L-1;
(2)对比三组数据可知,当加入固体的质量为18g时,剩余的9.6g固体全部是铜,由此可知n(Cu)= ![]() ,n(Fe)=
,n(Fe)= ![]() ,即n(Fe):n(Cu)= 1:1;故答案为:1:1。
,即n(Fe):n(Cu)= 1:1;故答案为:1:1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学小组需要480 mL 0.1000 mol/L的NaOH溶液。欲在实验室用固体烧碱配制。请回答下列问题:

(1)本实验需用托盘天平称量烧碱的质量为_____g。
(2)配制过程中,不需要的仪器(填写代号)________________。
a.烧杯 b.冷凝管 c.玻璃棒 d.1000mL容量瓶 e.漏斗 f.胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器有药匙、___、___。
(4)请说出本实验中玻璃棒的作用____________。
(5)将上图中的实验步骤A~F按实验过程先后次序排列______________。
(6)若配制过程中,其他操作都准确,下列操作能引起浓度偏高的有______(填代号)。
①用来溶解NaOH的烧杯里面有少许水
②未等稀释后的NaOH溶液冷却至室温就转移到容量瓶中
③将NaOH溶液转移到容量瓶时,不小心撒到了外面少许
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相等,其电子总数为30;D和E可形成4核10个电子的分子。
试回答下列问题:
(1)写出这五种元素的名称:A___,B____,C___,D__,E___。
(2)用电子式表示离子化合物A2B的形成过程___。
(3)按要求表示下列化合物的原子构成关系:
①D元素形成单质的电子式___;
②E与B形成化合物的电子式___;
③A、B、E形成化合物的电子式___;
④D与E两元素按原子数目比为1∶3和2∶4构成分子M和N,M的电子式___,N的结构式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不粘锅的内壁有聚四氟乙烯涂层,下列关于聚四氟乙烯的说法正确的是( )
A. 聚四氟乙烯的单体是不饱和烃
B. 聚四氟乙烯比较稳定
C. 聚四氟乙烯中氟的质量分数是73.1%
D. 聚四氟乙烯分子中含有双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种有机物2摩尔在氧气中充分燃烧,共消耗5摩尔氧气,生成二氧化碳和水各4摩尔,由此可以得到的结论是( )
A. 该有机物分子中含一个氧原子
B. 该有机物一个分子中含2个氧原子
C. 该有机物分子中不含有氧原子
D. 不能确定该有机物分子中是否含有氧原子及其个数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下两相同圆底烧瓶中分别充满①NH3,②NO2倒扣于水中进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为
A. ①>② B. ①<② C. ①=② D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸。在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:
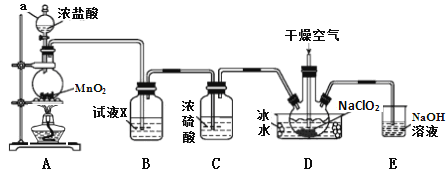
(1)仪器a的名称为_____________,装置A中反应的离子方程式为_______________。
(2)试剂X是_______________________。
(3)装置D中冰水的主要作用是___________。装置D内发生反应的化学方程式为_______________。
(4)装置E中主要反应的离子方程式为:____________________________。
(5)已知NaClO2饱和溶液在不同温度时析出的晶体情况如下表。
温度 | <38℃ | 38℃~60℃ | >60℃ |
析出晶体 | NaClO2·3H2O | NaClO2 | 分解成NaClO3和NaCl |
利用NaClO2溶液制得NaClO2晶体的操作步骤: 55℃蒸发结晶、_________、38~60℃的温水洗涤、低于60℃干燥。
(6)工业上也常用以下方法制备ClO2。
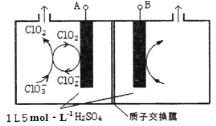
①酸性条件下双氧水与NaClO3反应,则反应的离子方程式为_______________________。
②如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。则阴极电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是

A.Y、Z、W三种元素电负性:W>Z>Y
B.Y、Z、W三种元素第一电离能:Z>W>Y
C.L的沸点一定比X、Y组成的化合物沸点高
D.由X、Y、Z、W构成的化合物中可能只含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com