
【题目】[选修3——物质结构与性质] 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)在Y的最高价氧化物分子中,Y原子轨道的杂化类型是_______________。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_______________________;Z的氢化物在固态时的密度比在液态时还小,其原因是_________
(3)Y与Z可形成YZ42-。
①YZ42-的空间构型为________________(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:_________________。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的
数目为_______。
(5)X与Y所形成化合物晶体的晶胞如图所:
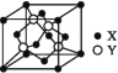
①在该晶体中,X离子的配位数为__________,与Y距离最近且距离相等的Y原子的数目为________。
②该晶胞的边长为a cm,该晶体的密度为__________________ g·cm-3。
【答案】sp2 水分子与乙醇分子之间形成氢键 在固态时水分子间主要以氢键结合,而氢键具有方向性,使水结成冰时体积膨胀,密度减小 正四面体 CCl4 16NA 4 12 388/ NA·a3(提示:晶胞中含有4个XY)
【解析】
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,则X原子核外电子数=2+8+18+2=30,则X原子序数为30,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,最外层电子数不超过8个,如果是K层,不超过2个,则Z原子核外电子数是8,为O元素;
(1)Y为S元素,最高正价为+6价,其氧化物为SO3,S原子价层电子对数=σ键数+孤电子对数;
(2)氢键能增大物质的溶解性;氢键具有方向性;
(3)①根据价层电子对互斥理论确定SO42-的空间构型;
②原子个数相等、价电子数相等的微粒为等电子体;
(4)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,一个化学式[Zn(NH3)4]Cl2中含有16个σ键,据此计算1mol该配合物中含有σ键的数目;
(5)晶胞为ZnS,根据晶胞结构确定S2-的配位数,以顶点的Zn2+为例,与之距离最近的Zn2+位于面心;利用均摊法计算该晶胞中S2-、Zn2+离子数目,从而确定其化学式;再结合ρ= 。
。
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,则X原子核外电子数=2+8+18+2=30,则X原子序数为30,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,最外层电子数不超过8个,如果是K层,不超过2个,则Z原子核外电子数是8,为O元素;
(1)Y为S元素,最高正价为+6价,其氧化物为SO3,S原子价层电子对数=σ键数+孤电子对数,即=3+![]() =3,故S原子轨道杂化类型为sp2杂化;
=3,故S原子轨道杂化类型为sp2杂化;
(2)Y的氢化物是H2S,Z的氢化物是H2O,H2S和乙醇分子之间不能形成氢键,H2O和乙醇分子之间能形成氢键,氢键的存在导致乙醇和水互溶;由于水在固态时水分子间主要以氢键结合,而氢键具有方向性,使水结成冰时体积膨胀,密度减小。导致固态H2O的密度比其液态时小;
(3)①SO42-的价层电子对个数=4+![]() ×(6+2-4×2)=4,且不含孤电子对,所以空间构型为正四面体;
×(6+2-4×2)=4,且不含孤电子对,所以空间构型为正四面体;
②SO42-的原子个数是5、价电子数是32,与硫酸根离子互为得电子体的有CCl4或SiCl4等;
(4)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,一个化学式[Zn(NH3)4]Cl2中含有16个σ键,则1mol该配合物中含有σ键的数目16NA;
(5)①由晶胞的结构可知,距离S2-最近的锌离子有4个,即S2-的配位数为4;晶胞中以顶点的Zn2+为例,与之距离最近的Zn2+位于面心,一个晶胞中共有3个,根据晶体的堆积方式可知,一个Zn2+被8个晶胞共用,且一个晶胞中距离最短的连线被两个晶胞共用,故符合条件的Zn2+共有![]() =12个;晶胞中S2-数目=8×
=12个;晶胞中S2-数目=8×![]() +6×
+6×![]() =4,Zn2+数目为4,即晶胞中含有4个ZnS,晶胞的质量为
=4,Zn2+数目为4,即晶胞中含有4个ZnS,晶胞的质量为![]() g,该晶胞的边长为acm,则体积为a3cm3,该物质的密度=
g,该晶胞的边长为acm,则体积为a3cm3,该物质的密度= =
=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() C和
C和![]() C是同一种核素
C是同一种核素
B.红磷和白磷互为同素异形体
C.CH3COOCH2CH3和CH3CH2COOCH3是不同物质
D.CH3CH2OH可看成是由-C2H5和-OH组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4CO 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据研究报道,药物瑞德西韦(Remdesivir)对2019年新型冠状病毒(COVID-19)有明显抑制作用。F为药物合成的中间体,其合成路线如下:
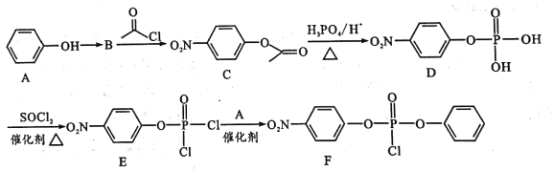
已知:R-OH![]() R-Cl
R-Cl
(1)A中官能团名称是________;C的分子式为_____
(2)A到B为硝化反应,则B的结构简式为___,A到B的反应条件是_____。
(3)B到C、D到E的反应类型 ________(填“相同”或“不相同”);E→F的化学方程式为________ 。
(4)H是C的同分异构体,满足下列条件的同分异构体有_____种。
①硝基直接连在苯环上
②核磁共振氢谱峰面积之比为2:2:2:1
③遇FeCl3溶液显紫色
(5)参照F的合成路线图,设计由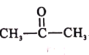 、SOCl2为原料制备
、SOCl2为原料制备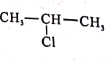 的合成路线_______(无机试剂任选)。
的合成路线_______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相等,其电子总数为30;D和E可形成4核10个电子的分子。
试回答下列问题:
(1)写出这五种元素的名称:A___,B____,C___,D__,E___。
(2)用电子式表示离子化合物A2B的形成过程___。
(3)按要求表示下列化合物的原子构成关系:
①D元素形成单质的电子式___;
②E与B形成化合物的电子式___;
③A、B、E形成化合物的电子式___;
④D与E两元素按原子数目比为1∶3和2∶4构成分子M和N,M的电子式___,N的结构式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是( )

A.电子由石墨I经负载流向石墨II,再经过熔融盐NaNO3返回石墨I,形成闭合回路
B.Y的化学式可能为NO
C.该装置可以将化学能→热能→电能
D.石墨I极的电极反应式为NO2+![]() ﹣e-═N2O5
﹣e-═N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不粘锅的内壁有聚四氟乙烯涂层,下列关于聚四氟乙烯的说法正确的是( )
A. 聚四氟乙烯的单体是不饱和烃
B. 聚四氟乙烯比较稳定
C. 聚四氟乙烯中氟的质量分数是73.1%
D. 聚四氟乙烯分子中含有双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮循环是生态系统物质循环的重要组成部分,人类活动影响了氮循环中的物质转化,如图所示。下列说法中,不正确的是

A.固氮过程中,发生了氧化还原反应
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于稳定N2在大气中的含量
D.同化过程,氮元素从有机物转移至无机物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com