
【题目】a、b、c、d四种短周期元素在周期表中的位置如图所示,a和b分别位于周期表的第2列和第13列,下列叙述正确的( )
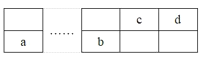
A.离子半径b>d
B.b可以和强碱溶液发生反应
C.c的最简单氢化物的稳定性强于d的
D.a的最高价氧化物对应水化物是强碱
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置。在实验开始时温度计水银球的位置应在___________,目的是_____________________________;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在___________________。

(3)烧杯B内盛装的液体可以是____________(写出一种即可)。
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是____________。(填字母)
a.pH试纸 b.碳酸氢钠粉末
c.红色石蕊试纸 d.银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出Fe的基态原子的电子排布式_________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为____________________,它们的氢化物沸点最高的是____________。其原因是__________,将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是_____________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______________。
②[Co(N3)(NH3)5]SO4中Co的配位数为____________,其配离子中含有的化学键类型为_______(填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______,其原因是_____________________。
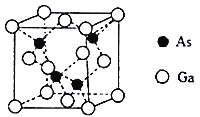
(4)砷化镓晶胞结构如图。晶胞中Ga与周围等距且最近的As形成的空间构型为________。已知砷化镓晶胞边长为apm,其密度为pg·cm-3,则阿伏加德罗常数的数值为__________________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分类如图所示:

由图判断下列说法中不正确的是( )
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一 定是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业中产生的NO是一种大气污染物,可以通过如下反应处理:2NO(g)+2CO(g) ![]() N2 (g)+ 2CO2(g); △H1。
N2 (g)+ 2CO2(g); △H1。
(1)已知:2CO(g)+O2(g)=2CO2(g);△H2=-566 kJ·mol-l,N2(g)+O2(g) ![]() 2NO(g); △H3=+181 kJ ·mol-l,则△H1=___________
2NO(g); △H3=+181 kJ ·mol-l,则△H1=___________
(2)在一定温度下,向体积为2L的密闭容器中充入4 moI NO、2 mol CO。
①若为恒容密闭容器,在10min时达到平衡状态,压强为原来的14/15,这段时间内,NO的平均反应速率为___________,平衡常数为___________L· mol-1,此时NO的转化率a%;平衡后,向恒容密闭容器中再充入2 mol NO、1 mol CO,重新达到平衡时,NO的转化率将___________(填“增大”、“不变”或“减小”);
②若为恒压密闭容器,平衡后NO的转化率为b%,则a%________b%(填“<”、“=”或>”)
(3)工业上,NO与CO混合气体以一定流速和一定的比例,通过填充有A、B催化剂的反应器,在A、B两种催化剂作用下,CO转化率与温度的关系如下图所示。

①工业上选择催化剂___________(填“A”或“B),理由是___________。
②在催化剂B作用下,高于550K时,CO转化率下降的理由可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①0. 1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.2 mol,则该烃的分子式为____________。结构简式为_________。
②某烷烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式为________,名称为___________ 。
(2)写出下列各种有机物的结构简式
①2,3-二甲基-4-乙基已烷 _________。
②支链只有一个乙基且相对分子质量最小的烷烃________。
③异戊烷(写出键线式)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题。

(1)第三周期元素中非金属性最强的元素的原子结构示意图是___。
(2)②③⑦最高价氧化物对应水化物的酸性由强到弱的顺序是___(填化学式)。
(3)下列可以判断⑤和⑥金属性强弱的是___(填序号)。
a.单质的熔点:⑤<⑥
b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥
d.最高价氧化物对应水化物的碱性:⑤>⑥
(4)为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:
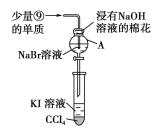
①仪器A的名称是___,A中发生反应的离子方程式是___。
②棉花中浸有NaOH溶液的作用是___(用离子方程式表示)。
③验证溴与碘的非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到___。该实验必须控制⑨单质的加入量,否则得不出溴的非金属性比碘强的结论。理由是___。
④第ⅦA族元素非金属性随元素核电荷数的增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐_____(填“增大”或“减小”),得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)今有常温下两种溶液:
(A)0.1mol·L-1NH3·H2O溶液 (B)0.1mol·L-1NH4Cl溶液
①溶液(A)的pH___7(填“>”“<”或“=”)。
②溶液(B)呈___性(填“酸”“碱”或“中”)。
③升高温度可以___(填“促进”或“抑制”)NH4Cl的水解。
④氮及其化合物在工农业生产、生活中有着重要作用。如图是1molNO2和1molCO反应生成NO和CO2过程中能量变化示意图。
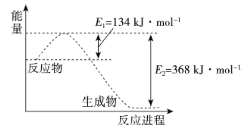
请写出NO2和CO反应的热化学方程式:___。
(2)已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)![]() C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
①升温时,C的反应速率___(填“加快”“减慢”或“不变”)。
②若平衡时,容器容积不变,增大压强,则平衡___。
A.一定向正反应方向移动 B.一定向逆反应方向移动
C.一定不移动 D.不一定移动
(3)①事实证明,原电池中发生的反应通常是放热的氧化还原反应。利用下列化学反应可以设计成原电池的是___。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)=2H2O(l) △H<0
该原电池的负极是通入___(填“氢气”或“氧气”)的一极。
②以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应式为___。
③电解原理在化学工业中有着广泛的应用。如图所示电解池中,a为NaCl溶液,X和Y是两块惰性电极板,则电解时的离子方程式为___。
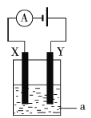
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是

A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com