
【题目】已知:①2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=2H2O(l)+CO2(g) ΔH=-890kJ·mol-1
(1)已知H—H键的键能为436kJ·mol-1,O=O键的键能为496kJ·mol-1,H—O键的键能为463kJ·mol-1,根据上述数据通过键能可直接计算出反应___(填反应序号)的焓变,由反应①②可得出反应比H2O(l)=H2O(g)的焓变ΔH=___。
(2)根据题干可计算出CO2(g)+4H2(g)=CH4(g)+2H2O(g)的焓变ΔH=___。
(3)在①②③三个热化学方程式中,可表示燃烧热的热化学方程式的是___(填序号)。标准状况下,取甲烷和氢气的混合气体11.2L,完全燃烧后恢复到常温,放出的热量为263.8kJ,则混合气体中甲烷和氢气的体积比为___。
【答案】② +44kJ·mol-1 -166kJ·mol-1 ③ 2:3
【解析】
(1)在标准状况下,将1mol气态分子解离为气态原子所需的能量或者气态原子形成1mol气态分子所放出的能量叫键能,结合所给键能,能直接计算②的焓变,将两个热化学方程式作如下处理:![]() 得H2O(l)=H2O(g),所以H2O(l)=H2O(g)的焓变ΔH=
得H2O(l)=H2O(g),所以H2O(l)=H2O(g)的焓变ΔH=![]() =+44kJ·mol-1,故答案为:②;+44kJ·mol-1;
=+44kJ·mol-1,故答案为:②;+44kJ·mol-1;
(2)将热化学方程式作如下处理:①+②-③得:CO2(g)+4H2(g)=CH4(g)+2H2O(g),所以,CO2(g)+4H2(g)=CH4(g)+2H2O(g)的ΔH=-572kJ·mol-1+(-484kJ·mol-1)-(-890kJ·mol-1)= -166kJ·mol-1,故答案为:-166kJ·mol-1;
(3)1mol可燃物完全燃烧生成稳定的化合物所放出的热量称为燃烧热。①氢气物质的量不是1mol,②H元素燃烧产生的稳定化合物应为液态水,③满足条件,故能代表燃烧热的热化学方程式为③。设甲烷的物质的量为x,氢气的物质的量为y,可得:x+y=![]() ,混合气体完全燃烧恢复到室温下,由2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1可知,每2molH2燃烧放出572kJ热量,那么y mol燃烧放出
,混合气体完全燃烧恢复到室温下,由2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1可知,每2molH2燃烧放出572kJ热量,那么y mol燃烧放出![]() kJ=286ykJ热量,由CH4(g)+2O2(g)=2H2O(l)+CO2(g) ΔH=-890kJ·mol-1可知,每1molCH4完全燃烧放出890kJ热量,所以x mol燃烧放出890x kJ的热量,所以286y +890x =263.8,结合x+y=
kJ=286ykJ热量,由CH4(g)+2O2(g)=2H2O(l)+CO2(g) ΔH=-890kJ·mol-1可知,每1molCH4完全燃烧放出890kJ热量,所以x mol燃烧放出890x kJ的热量,所以286y +890x =263.8,结合x+y=![]() =0.5mol解得:x=0.2mol,y=0.3mol。同温同压下,任何两种气体的体积比等于物质的量之比,故混合气体中甲烷和氢气的体积比=0.2mol:0.3mol=2:3,故答案为:③;2:3。
=0.5mol解得:x=0.2mol,y=0.3mol。同温同压下,任何两种气体的体积比等于物质的量之比,故混合气体中甲烷和氢气的体积比=0.2mol:0.3mol=2:3,故答案为:③;2:3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①存在阳离子的物质中一定存在阴离子
②金属元素原子和非金属元素原子之间一定形成离子键
③离子键的实质是阳离子、阴离子间的相互吸引
④根据电离方程式![]() ,可判断HCl分子中存在离子键
,可判断HCl分子中存在离子键
⑤某些离子化合物中含有共价键
A.仅①②⑤B.仅③C.仅③④D.仅⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
B. HOCH2CH(CH3)2与(CH3)3COH属于碳链异构
C. 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
D. 一个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
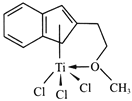
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A.pH=a的氨水,稀释10倍后,其pH=b,则a<b+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH<7
C.向10mL0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
D.向10mLpH=11的氨水中加入10mLpH=3的H2SO4溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备乙炔,并验证乙炔的某些化学性质,已知制备的乙炔气体中往往含有少量的![]() 气体。请回答下列问题:
气体。请回答下列问题:

(1)实验室制备乙炔的化学方程式为________;为了使产生乙炔的气流平稳,装置![]() 的分液漏斗中常用______________代替水。
的分液漏斗中常用______________代替水。
(2)装置![]() 中
中![]() 溶液的作用是________,发生反应的离子方程式为_________。
溶液的作用是________,发生反应的离子方程式为_________。
(3)装置![]() 中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
(4)装置![]() 中观察到的现象是________。
中观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及导电性变化如图。
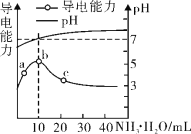
下列分析正确的是
A.HR为强酸
B.加入10 mL 氨水时,溶液中c(NH4+)>c(R-)
C.c点溶液存在c(NH4+)<c( R-)
D.b点的离子浓度大于a点的离子浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的电子垃圾处理不当会对环境构成威胁。某研究小组将废弃的线路板处理后,得到含Cu、Al及少量Fe的金属混合物,并设计如下流程制备硫酸铜和硫酸铝晶体。

请回答:
(1)步骤①~③所涉及的实验操作方法中,属于过滤的是______(填序号)。
(2)步骤①中Cu、Al、Fe均能与稀硫酸和浓硝酸的混合物在加热条件下反应,其中氮元素全部转化为NO。该步骤中稀硫酸的作用是______。
(3)下列关于步骤②的说法正确的是______(填字母)。
a 沉淀B为白色固体
b H2O2的作用是将Fe2+氧化为Fe3+
c 可以用Ba(OH)2溶液替换NaOH溶液
(4)已知AlO2-+ 4H+=Al3+ + 2H2O。由沉淀B制取Al2(SO4)3·18H2O的操作是:将沉淀B转移到烧杯中,______,将溶液加热蒸发、冷却结晶、过滤得到产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管中进行下列实验,现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向硫酸铜水溶液中逐滴加入氨水 | 先产生蓝色沉淀,然后溶解,最后得到深蓝色透明溶液 |
B | 向I2的CCl4溶液中加入浓KI溶液,振荡 | 溶液紫红色变浅 |
C | 向橙色的K2Cr2O7溶液中加入10滴浓硫酸,振荡 | 溶液由橙色变为黄色 |
D | 向饱和硼酸溶液中加入Na2CO3溶液 | 无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com