

| 组别 | 温度(℃) | 起始浓度(mol/L) | 反应达平衡时所需时间(min) | 平衡浓度(mol/L) c(CO2)或c(H2) | |
| c(CO) | c(H2O) | ||||
| Ⅰ | 800 | 1.00 | 1.00 | 10 | 0.50 |
| Ⅱ | 800 | 1.00 | 4.00 | t2 | c2 |
| Ⅲ | 800 | 1.00 | 1.00 | 1 | 0.50 |
| Ⅳ | 1000 | 1.00 | 1.00 | 8 | 0.40 |
| Ⅴ | 1000 | 2.00 | 2.00 | t5 | c5 |
| △c(CO) |
| △t |
| 0.5mol?L-1 |
| 10min |
| x?x |
| (1-x)?(4-x) |
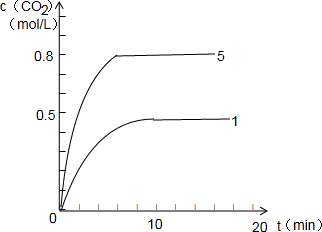 ,故答案为:
,故答案为: ;
;| 1.0×3.0 |
| 1.0x |


科目:高中化学 来源: 题型:
 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )| A、苯在一定条件能发生取代反应 |
| B、苯能与H2发生加成反应 |
| C、邻二溴苯只有一种 |
| D、溴苯没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钋是第84号元素 |
| B、钋是能导电的固体 |
| C、钋的氢化物很稳定 |
| D、钋可能有两种不同价态的氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com