
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.常温常压下,11.2 LNH3所含的原子数为2NA
B.标准状况下,22.4 LCl2所含的原子数为NA
C.常温常压下,80 gSO3所含的氧原子数为3NA
D.一定条件下,56 g铁与足量HNO3完全反应,转移电子数为2NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.01molL-1HA溶液中逐滴加入0.02molL -1MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计)。下列说法中不正确的是( )

A.MOH为一元弱碱
B.MA稀溶液pH<7
C.N点水的电离程度大于K点水的电离程度
D.K点对应的溶液的pH=10,则c(MOH)+c(OH)-c(H+)=0.01molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积的下列气体:①NO2,②HC1,③NH3。现将3支试管均倒置于水槽中,充分溶解后,所得溶液的物质的量浓度大小关系正确的是
A.①>②>③B.①=②=③C.②=③>①D.③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷基烯酮二聚体(AKD)是造纸工业上常用的一种浆内施胶剂,其结构简式如图所示,下列说法正确的是( )
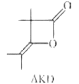
A.AKD的分子式为C8H14O2
B.AKD与NaOH溶液能发生皂化反应
C.AKD分子中所有碳原子处于同一平面
D.AKD能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
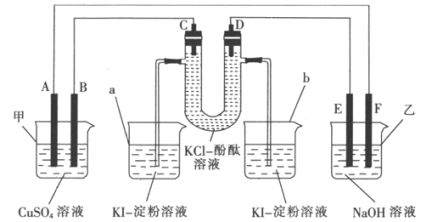
(1)判断装置的名称:甲池为_________(填“电解池”或“原电池”,下同),乙池为_________。
(2)B极为_________ (填“正极”或“负极”或“阳极”或“阴极”,下同),电极反应式为_________;F极为_________,电极反应式为__________________。
(3)U形管中溶液先变红的是_________(填“C”或“D”)极,U形管中发生反应的化学方程式为________________________________________。
(4)当烧杯中有38.1 g I2(KI足量)生成时,甲池中溶液的质量会减少________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在T1温度下,向容积为1L的恒容密闭容器中,同时通入0.1mol CO(g)和0.1mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。

(1)0~10min内,CO的平均反应速率为_____________
(2)T1温度下,该反应的平衡常数K为_______________(用分数表示)。
(3)已知:I.H2的燃烧热 △H=-285.8 kJ·mol-1;
II.CO的燃烧热 △H=-283 kJ·mol-1;
III.H2O(g)![]() H2O(l) △H=-44 kJ·mol-1。则a=______________
H2O(l) △H=-44 kJ·mol-1。则a=______________
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1、c(H2)=0.4 mol·L-1、c(CO2)=0.4 mol·L-1,则该反应在下一时刻将_______ (填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键吸收的能量或形成1mol化学键释放的能量称为键能,部分物质的键能如下表所示:甲醛结构式为:![]() ,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
6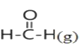 +4NH3(g)→
+4NH3(g)→ +6H2O(l)
+6H2O(l)
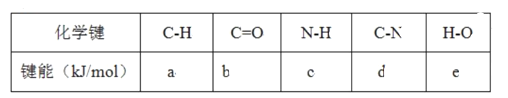
A. 6(a+b+c-d-e) kJ·mol-1B. 6(d+e-a-b-c) kJ·mol-1
C. 6(b+2c-2d-2e) kJ·mol-1D. 6(2d+2a+2e-b-3c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com