
【题目】2NO2(g)![]() N2O4(g)反应过程的能量变化如图所示。
N2O4(g)反应过程的能量变化如图所示。
已知1 mol NO2(g)转化为0.5 mol N2O4(g)的ΔH=28.6 kJ·mol1。

请回答下列问题:
(1)该反应属于 反应(填“放热”或“吸热”)。
(2)从化学键的角度分析,E、F、ΔH1分别代表什么意义?
E ;F ; ΔH1 。
(3)图中ΔH1= kJ·mol1。
(4)若1 mol NO2(g)转化为0.5 mol N2O4 (l)的ΔH'=Q kJ·mol1,则ΔH ΔH',Q 28.6(填“>”、“<”或“=”)。
【答案】(1)放热
(2)断裂旧化学键吸收的能量 形成新化学键释放的能量
2 mol NO2(g)完全转化为1 mol N2O4 (g)时的焓变
(3)57.2 (4)> >
【解析】(1)因ΔH=28.6 kJ·mol1<0,故所给反应为放热反应。
(2)从化学键的角度分析化学反应的实质是旧化学键的断裂和新化学键的形成,故E代表破坏旧化学键时吸收的能量,F表示形成新化学键时释放的能量,ΔH1表示破坏旧化学键吸收的能量与形成新化学键释放的能量差即反应的热效应。
(3)图中ΔH1应表示2 mol NO2(g)在完全转化为1 mol N2O4 (g)时的焓变,即ΔH1=(28.6 kJ·mol1)×2= 57.2 kJ·mol1。
(4)比较ΔH大小时,要连同“+”、“”符号一起比较,由题意可知N2O4的状态不同,则反应热也不相同。因为N2O4 (g)在转化为N2O4 (l)时会放热,即1 mol NO2(g)生成0.5 mol N2O4 (l)时释放的能量比生成0.5 mol N2O4 (g)时释放的能量多,即Q>28.6,则ΔH>ΔH'。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O![]() 6Cu+SO2↑。下列关于该反应的说法中,正确的是
6Cu+SO2↑。下列关于该反应的说法中,正确的是
A. 每生成22.4L SO2,反应中转移6 mol电子
B. Cu2S在反应中既是氧化剂,又是还原剂
C. Cu既是氧化产物又是还原产物
D. 每生成19.2 g Cu,反应中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究化学反应中的能量变化时我们通常做如图所示的实验。
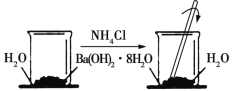
在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先滴有3~4滴水的玻璃片(或三合板)上,然后向烧杯内加入NH4Cl晶体约10 g,并立即用玻璃棒迅速搅拌。
试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是 。
(2)如果实验中没有看到“结冰”现象,可能的原因是 (要求答出三个以上的原因)。
(3)如果实验中没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?
(要求答出两种方案)。
(4)该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学与生产、生活的认识错误的是
A. CO2、SO2、N2等均是造成温室效应的气体
B. 节能减排符合低碳经济的要求
C. 使用清洁能源是防止酸雨发生的重要措施之一
D. 大量焚烧田间秸秆会污染空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个简易测量物质反应是吸热还是放热的实验装置。将镁片加入小试管内,然后注入足量的盐酸。

请根据要求回答下列问题:
(1)有关反应的离子方程式是__________________________________。
(2)试管中观察到的现象是__________________________________。
(3)U形管中左端液面 (填“上升”或“下降”),原因是________________________________,说明此反应是______(填“放热”或“吸热”)反应。
(4)由实验推知,MgCl2和H2的总能量____________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题:如图是某硫酸试剂瓶标签上的内容。

(1)该硫酸的物质的量浓度是____________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需用490 mL 4.6 mol/L的稀硫酸,则要量取该硫酸的体积为_____________mL。
(3)按题(2)的要求配制溶液时,右图中肯定不需要用到的实验仪器是________(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要_______________(填仪器名称)。

(4)在下列配制过程示意图中,有错误的是(填写序号) __________________。

(5)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏低的是_____。
A.未经冷却趁热将溶液注入容量瓶中
B.容量瓶洗涤后,未经干燥处理
C.定容时仰视观察液面
D.摇匀后发现液面低于刻度线继续加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( )
A. 0.1(b-2a)mol·L-1 B. 10(2a-b) mol·L-1
C. 10(b-2a) mol·L-1 D. 10(b-a) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1997年,第一只“克隆羊”在英国诞生,“克隆羊”的关键技术之一是找到一些特殊的酶,它们能激活普通体细胞,使之像生殖细胞一样发育成个体。下列有关酶的叙述错误的是
A.酶是具有催化功能的蛋白质
B.酶的催化作用具有选择性和专一性
C.酶通常在强酸或强碱条件下发挥作用
D.高温或紫外线照射会降低酶的活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B两种气体在一定条件下可以发生反应:2A+B![]() C+3D,现将2 mol A气体与1 mol B气体充入一个密闭容器中,温度和压强恒定的情况下,测得反应后气体体积为反应前的一半,且测得放出的热量为198 kJ,则下列热化学方程式可能正确的是( )
C+3D,现将2 mol A气体与1 mol B气体充入一个密闭容器中,温度和压强恒定的情况下,测得反应后气体体积为反应前的一半,且测得放出的热量为198 kJ,则下列热化学方程式可能正确的是( )
A. 2A(g)+B(g) ![]() C(g)+3D(g) ΔH=-198kJ·mol-1
C(g)+3D(g) ΔH=-198kJ·mol-1
B. C(g)+3D(l) ![]() 2A(g)+B(g) ΔH=+198kJ·mol-1
2A(g)+B(g) ΔH=+198kJ·mol-1
C. 2A(g)+B(g) ![]() C(g)+3D(l) ΔH=-198kJ·mol-1
C(g)+3D(l) ΔH=-198kJ·mol-1
D. C(g)+3D(l) ![]() 2A(g)+B(g) ΔH=+264kJ·mol-1
2A(g)+B(g) ΔH=+264kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com