


| ||
| 5.0g |
| 0.5mol/L×0.25L×56g/mol |
| 10g |
| 10.0g×24% |
| 16g/mol |
| 10.0g×70% |
| 56g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C的体积分数下降 |
| B、a+b>p |
| C、正反应速率和逆反应速率均减小,平衡向逆反应方向移动 |
| D、正反应速率和逆反应速率均加大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


 的合成路线流程图(无机试剂任选).合成路线流程示意图为:
的合成路线流程图(无机试剂任选).合成路线流程示意图为:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的摩尔质量为: |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为: |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱如下图: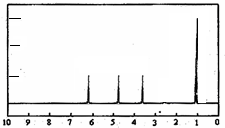 | (4)A中含有 |
| (5)综上所述,A的结构简式 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有关微粒氧化性强弱排序为:KMnO4>Cl2>SO2 |
| B、反应②中氯化氢表现出还原性和酸性 |
| C、反应①中氧化产物与还原产物的质量比为:73:98 |
| D、有关微粒还原性强弱排序为:SO2>Cl->Mn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com