
【题目】曲酸和脱氧曲酸是一种非常有潜力的食品添加剂,结构如图所示。下列有关叙述不正确的是
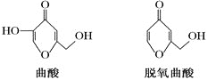
A.曲酸分子中所有原子不可能共平面
B.脱氧曲酸能发生酯化反应、氧化反应、还原反应
C.曲酸与脱氧曲酸所含的官能团相同
D.与脱氧曲酸互为同分异构体的芳香族化合物有4种![]() 不考虑
不考虑![]() 键
键![]()
【答案】D
【解析】
曲酸和脱氧曲酸结构中均存在醇羟基、醚键、羰基和碳碳双键,具有烯烃、醇、醚和酮的性质,能发生加成、取代、加聚、氧化等反应,且碳碳双键、羰基为平面结构,-CH2OH为四面体结构,据此分析判断。
A. 曲酸分子中存在-CH2OH结构,为四面体结构,因此所有原子不可能共平面,A项正确,不符合题意;
B. 脱氧曲酸结构中含有碳碳双键和醇羟基,能发生酯化反应、氧化反应、还原反应,B项正确,不符合题意;
C. 曲酸与脱氧曲酸结构中均存在醇羟基、醚键、羰基和碳碳双键,所含的官能团相同,C项正确,不符合题意;
D. 脱氧曲酸结构中含有3个双键,1个环,不饱和度为4,共有6个碳原子,与其互为同分异构体的芳香族化合物的苯环上连接3个-OH,共有3种,D项错误,符合题意;
答案选D。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】目前比较热门的Al-H2O2电池,其电池总反应为2Al+![]() =
=![]() +OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
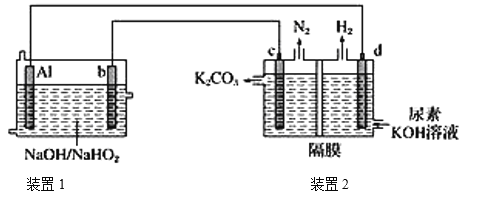
A.装置1中Na+移向电极b,装置2中的隔膜可以换成质子交换膜
B.电极c的电极反应式:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O
C.电解时,电流的流动路径:Al极→导线→d极→电解质溶液→c极→导线→b极
D.通电5 min后,若Al电极的质量减轻5.4g,则产生H2的体积为4.48L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中 A 和 F 中装有乙醇和浓硫酸的混合液,D 中的试管里装有液溴。A 中可能存在的副反应有:①乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚。②温度过高产生 CO2(夹持装置已略去)
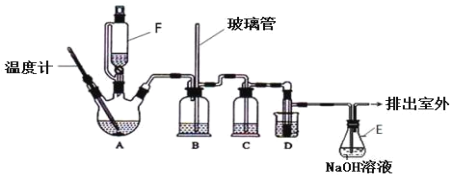
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
填写下列空白:
(1)A 中发生的主反应的化学方程式:_____;
(2)D 中发生反应的化学方程式为:_____。
(3)安全瓶 B 可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶 B 中的现象_____。
(4)在装置 C 中应加入_____,其目的是吸收反应中可能生成的酸性气体。
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(5)容器 E 中 NaOH 溶液的作用是_____。
(6)若产物中有少量副产物乙醚,可用_____(填操作名称)的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
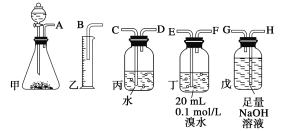
(1)进行实验时,所制气体从左向右流,仪器的正确连接顺序是________________(填接口字母);
(2)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用__________;
(3)若没有除H2S的装置,测定结果将会__________(填“偏高”、“偏低”或“不变”),理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
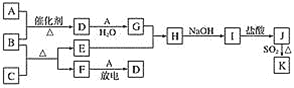
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应:2A(g)+B(g)![]() 3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
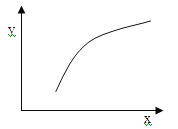
选项 | x | y |
A | A的浓度 | 平衡常数K |
B | 温度 | 混合气体的密度 |
C | B的物质的量 | A的转化率 |
D | 催化剂的质量 | C的体积分数 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。下列说法不正确的是 ( )
出发合成BHT的方法有如下两种。下列说法不正确的是 ( )
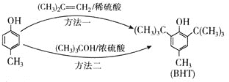
A.![]() 的同分异构体中属于芳香族化合物的共有4种
的同分异构体中属于芳香族化合物的共有4种
B.BHT与![]() 都能使酸性
都能使酸性![]() 溶液褪色
溶液褪色
C.方法一和方法二的反应类型都是加成反应
D.BHT与![]() 具有完全相同的官能团
具有完全相同的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要意义,其反应历程示意图如图:

下列说法不正确的是( )
A.合成气的主要成分为CO和H2
B.①→②过程可表示为CO2+NiC=2CO+Ni
C.①→②过程吸收能量
D.Ni在该反应中做催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com