
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
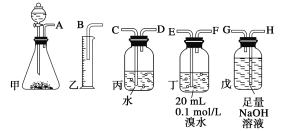
(1)进行实验时,所制气体从左向右流,仪器的正确连接顺序是________________(填接口字母);
(2)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用__________;
(3)若没有除H2S的装置,测定结果将会__________(填“偏高”、“偏低”或“不变”),理由是________________________。
【答案】AHGEFDCB 饱和食盐水 偏高 H2S+Br2=S↓+2HBr
【解析】
(1)电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积;
(2)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
(3)硫化氢具有还原性,能够与溴发生氧化还原反应,导致测得乙炔的物质的量偏多。
(1)电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积,所制气体从左向右流,仪器的正确连接顺序是:AHGEFDCB;
故答案为:AHGEFDCB;
(2)为了使实验中气流平稳,实验室一般用饱和食盐水代替水进行实验;
故答案为:饱和食盐水;
(3)硫化氢具有还原性,能够与溴发生氧化还原反应,导致测得乙炔的物质的量偏多,最终测得电石的纯度偏高,发生H2S+Br2=S↓+2HBr,故答案为:偏高;H2S+Br2=S↓+2HBr。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
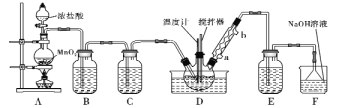
(1)A装置中的离子反应方程式为 ________________________________________________。
(2)一氯化硫(S2Cl2)常温下为液态,较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式:____________________________。
(3)C、E装置中所盛溶液为__________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为海水综合利用的部分流程,下列有关说法错误的是( )
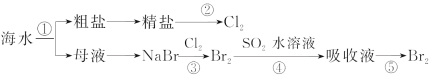
A.实验室进行①的操作需要用到坩埚、玻璃棒、酒精灯
B.②是一个将电能转化为化学能的过程
C.③④⑤涉及的反应均为氧化还原反应
D.④中反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】姜黄素是一种天然染料,工业上可用石油的裂解产物通过如下反应制得:
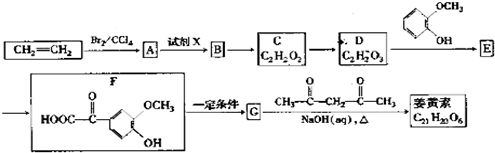
已知:①![]()
②![]()
请回答下列问题:
(1)试剂X为___________;
(2)1molE最多能消耗Na、NaOH、NaHCO3的物质的量分别为3mo1、2mol、1mol,则E的结构简式为___________;
(3)姜黄素中的含氧官能团除甲氧基(CH3O-)外还有___________(写名称).
(4)反应B→C的化学方程式为___________,其反应类型是___________;
(5)符合下列条件G的同分异构体共有___________种,其中核磁共振氢谱中有5组峰,且面积比为2:2:2:1:1的是___________;
①属于芳香酯类 ②苯环上有两个取代基 ③能与FeCl3溶液发生显色反应
(6)借鉴制取姜黄素的方法也能合成肉桂醛 (![]() ),写出制备肉桂醛所需有机物的结构简式___________
),写出制备肉桂醛所需有机物的结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
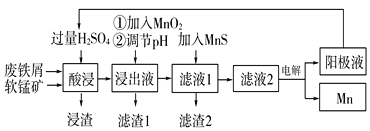
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
A | |||||||||
C | D | ||||||||
B | E | F | |||||||
(1)画出D的原子结构示意图________ ;
(2)A和F两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。;
(3)E和F分别形成的气态氢化物中最稳定的是_________(填写氢化物的化学式)
(4)B的最高价氧化物的水化物的化学式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是一种非常有潜力的食品添加剂,结构如图所示。下列有关叙述不正确的是
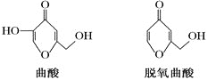
A.曲酸分子中所有原子不可能共平面
B.脱氧曲酸能发生酯化反应、氧化反应、还原反应
C.曲酸与脱氧曲酸所含的官能团相同
D.与脱氧曲酸互为同分异构体的芳香族化合物有4种![]() 不考虑
不考虑![]() 键
键![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物共15 g,投入足量的盐酸中,充分反应后得到11.2 L H2(标准状况),则原混合物的组成肯定不可能为 ( )
A. Mg和Ag B. Zn和Cu
C. Al和Zn D. Al和Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com