
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
A | |||||||||
C | D | ||||||||
B | E | F | |||||||
(1)画出D的原子结构示意图________ ;
(2)A和F两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。;
(3)E和F分别形成的气态氢化物中最稳定的是_________(填写氢化物的化学式)
(4)B的最高价氧化物的水化物的化学式_____________。
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用碳资源的研究越来越紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
如表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H ________0 ( 填“>”、 “ < “ 或 “ = ”) ;
②判断反应达到平衡状态的依据是________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
③借助上表数据判断,要提高CO的转化率,可采取的措施是________.
A.升温 B.充入更多H2 C.分离出甲醇 D.加入催化剂
(2)CH3OH可以用做燃料电池的燃料,以甲醇与氧气的反应为原理设计,现有电解质溶液是KOH溶液的燃料电池。请写出该电池负极的电极反应式:____________________.
(3)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构。层内的 H3BO3 分子通过氢键相连(如下图)。下列有关说法正确的是( )
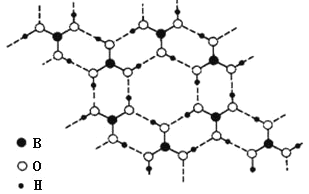
A.正硼酸晶体属于原子晶体
B.正硼酸晶体层与层之间的作用力是范德华力
C.含 1molH3BO3 的晶体中有 2mol 氢键
D.分子中 B 原子杂化轨道的类型为 sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4;C4H10→CH4+C3H6;某化学兴趣小组的同学为测定丁烷裂解气中CH4的物质的量,设计实验如图所示:

(注:CuO能将烃氧化成CO2和H2O; Al2O3是催化剂,G后面装置已省略。)
如图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是: 。
(2)B装置所起的作用是 。
(3)写出C2H6在G中的化学方程式: 。
(4)实验室中对E装置中的混和物按下图操作:
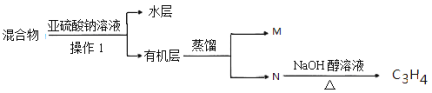
①操作I中用到玻璃仪器是 ,写出M的分子式 。
②亚硫酸钠溶液的作用是(用离子方程式表示) 。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应,当(E和F)装置的总质量比反应前增加了15.4g,G装置中固体质量减少了30.4g,则丁烷的裂解产物中n(CH4)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
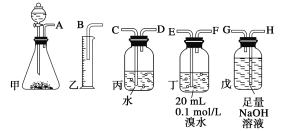
(1)进行实验时,所制气体从左向右流,仪器的正确连接顺序是________________(填接口字母);
(2)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用__________;
(3)若没有除H2S的装置,测定结果将会__________(填“偏高”、“偏低”或“不变”),理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用于催化剂、颜料、防腐等工业。某兴趣小组设计实验制备氯化亚铜。回答下列问题:

制法一:将铜粉加入B反应器中,与一定浓度的食盐—盐酸溶液相互作用,在60~70℃通入氧气,充分反应(部分仪器略去)。
①仪器X的名称___,X中盛有二氧化锰,分液漏斗中盛放双氧水,则A装置中发生反应的化学方程式是___。

②反应结束后,打开瓶塞 a,倾出反应液于大烧杯中,为防止外溅,通常采用的操作方法是___。
制法二:将氯化铜与氯化钠加水溶解,并调节酸度,加入铜粉一起加热,Cu2+被单质铜还原,生成可溶性的配合物Na[CuCl2],再经水解后产生白色沉淀。抽滤,沉淀依次用水、无水乙醇洗涤多次,得白色固体产品
①写出该法生成Na[CuCl2]的化学反应方程式___。
②用水洗涤CuCl沉淀的具体操作为___,沉淀水洗后再用无水乙醇洗涤的原因是___。
③判断CuCl是共价化合物还是离子化合物的实验方法是___。
制法三:以铜为电极,电解饱和食盐水也可制得CuCl。阳极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验: 上面对照实验不能完成实验目的的是

A.![]() 、
、![]() 对照,比较
对照,比较![]() 、
、![]() 中羟基氢原子的活泼性
中羟基氢原子的活泼性
B.![]() 、
、![]() 对照,说明
对照,说明![]() 中存在不同于烃分子中的氢原子
中存在不同于烃分子中的氢原子
C.![]() 、
、![]() 对照,能说明苯环对羟基的化学性质产生影响
对照,能说明苯环对羟基的化学性质产生影响
D.![]() 和
和![]() 、
、![]() 和
和![]() 对照,说明官能团对有机物的化学性质起决定作用
对照,说明官能团对有机物的化学性质起决定作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com