
【题目】某同学做如下实验: 上面对照实验不能完成实验目的的是

A.![]() 、
、![]() 对照,比较
对照,比较![]() 、
、![]() 中羟基氢原子的活泼性
中羟基氢原子的活泼性
B.![]() 、
、![]() 对照,说明
对照,说明![]() 中存在不同于烃分子中的氢原子
中存在不同于烃分子中的氢原子
C.![]() 、
、![]() 对照,能说明苯环对羟基的化学性质产生影响
对照,能说明苯环对羟基的化学性质产生影响
D.![]() 和
和![]() 、
、![]() 和
和![]() 对照,说明官能团对有机物的化学性质起决定作用
对照,说明官能团对有机物的化学性质起决定作用
【答案】C
【解析】
A. 与钠反应越剧烈,说明分子中羟基氢越活泼;
B. 乙醇与钠反应生成气体,而煤油不反应,说明乙醇分子中含有不同于烃分子中的氢原子;
C. 苯酚与溴水反应,证明了羟基对苯环产生影响;
D. ![]() 和
和![]() 、
、![]() 和
和![]() 对照,说明醇羟基、酚羟基等官能团决定了有机物的性质。
对照,说明醇羟基、酚羟基等官能团决定了有机物的性质。
A. 钠与水反应剧烈程度远大于钠在乙醇中反应的剧烈程度,所以①、②对照可以比较水和乙醇中羟基氢原子的活泼性,A项正确,不符合题意;
B. 乙醇和煤油中都含有烃分子,但钠在乙醇中反应现象和钠在煤油中的反应现象不同,说明乙醇中存在不同于烃分子中的氢原子,B项正确,不符合题意;
C. 溴水与苯不反应,而苯酚中有苯环外,还有酚羟基,由于酚羟基对苯环影响,使苯环上的邻对的H原子非常活泼,所以苯酚能与溴水反应生成三溴苯酚,说明羟基对苯环的化学性质产生了影响,C项错误,符合题意;
D.经过上面五组对照实验可得知官能团对有机物的化学性质起决定性作用,D项正确,不符合题意;
答案选C。


科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的,从海水中提取的MgCl2制得Mg和Cl2,进一步联合用金红石(主要成分TiO2)冶炼金属钛,工业上其主要的生产流程如下:
|
回答下列问题:
(1)加入过量试剂①后,能够分离得到Mg(OH)2沉淀的方法操作1用到的玻璃仪器有________________________________________;试剂②可以选用______。
(2)要得到MgCl2·6H2O的操作2名称是___________________________________。
(3)工业上冶炼金属钛的上述生产流程,其第1步是在高温下向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体,写出这步反应的化学方程式:____________________________。
(4) 工业上冶炼金属钛的上述生产流程,其第2步是在稀有气体氛围和加热的条件下,用镁与TiCl4反应得到钛,写出这步反应的化学方程式____________________,该反应时稀有气体氛围的作用是_____________________________________,该反应的金属冶炼方法属于是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
A | |||||||||
C | D | ||||||||
B | E | F | |||||||
(1)画出D的原子结构示意图________ ;
(2)A和F两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。;
(3)E和F分别形成的气态氢化物中最稳定的是_________(填写氢化物的化学式)
(4)B的最高价氧化物的水化物的化学式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物共15 g,投入足量的盐酸中,充分反应后得到11.2 L H2(标准状况),则原混合物的组成肯定不可能为 ( )
A. Mg和Ag B. Zn和Cu
C. Al和Zn D. Al和Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗结肠炎药物的有效成分(R)的结构简式如下。下列说法不正确的是

A. R能发生加成、取代反应
B. R分子中所有C和N原子一定共平面
C. R的苯环上官能团位置异构体有10种
D. R的分子式为C7H7O3N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法不正确的是()
A.![]() 、
、![]() 、
、![]() 中只有
中只有![]() 可与酸性高锰酸钾溶液反应且所有原子处于同一平面
可与酸性高锰酸钾溶液反应且所有原子处于同一平面
B.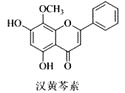 与足量
与足量![]() 发生加成反应后,该分子中官能团的种类减少2种
发生加成反应后,该分子中官能团的种类减少2种
C.以淀粉为有机原料可制取乙酸乙酯
D. 、
、![]() 均可作为聚合反应的单体
均可作为聚合反应的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
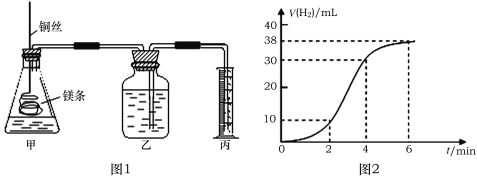
(1)请在图中画出上述反应中H2的速率与时间的关系曲线______________。
(2)在前4 min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOX)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
(1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) H2= -574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) H3= -1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是________ 。
(2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2xCO(g)N2(g)+2xCO2(g) H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:

①甲容器中,平衡时NO2的转化率为____;
②T1___T2(填“>”或“<”);△H___0(填“>”或“<”),判定的依据是____;
③T2温度时,该反应的平衡常数K=____;
④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)___v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com