
【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
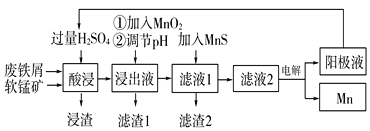
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
【答案】增大反应物的接触面积,增大反应速率 将浸出液中的Fe2+氧化为Fe3+ H2O2 3.7 H2SO4 1.4×1011 Mn2++2H2O-2e-=MnO2+4H+ ![]()
【解析】
用软锰矿还原酸浸制取硫酸锰电解液并进一步提炼金属锰,软锰矿和废铁屑加入过量硫酸浸出,过滤,浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等金属离子,加入MnO2的作用是将浸出液中的Fe2+氧化为Fe3+,同时自身被还原为Mn2+,加入氨水调节溶液的pH以除去铁离子,过滤后的滤液中加入MnS净化除去Co2+、Ni2+等,过滤得到滤液电解得到金属锰和阳极液,阳极液中的硫酸循环使用,滤渣2为MnS、CoS、NiS,据此分析解题。
(1)“酸浸”前将原料粉碎,增大了反应物的接触面积,从而加快反应速率;
(2)流程图中“①加入MnO2”的作用是将浸出液中的Fe2+氧化为Fe3+,同时自身被还原为Mn2+,MnO2作氧化剂,可以用试剂H2O2代替;
(3)流程图中“②调节pH”可以除去铁离子,由表中数据可知:Fe3+完全沉淀时的溶液pH=3.7,则应将溶液pH调节控制的范围是3.7~7.6;上述工艺中,能循环使用的一种物质是电解过程中阳极液含的H2SO4;
(4)Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21],沉淀转化的方程式为:MnS+Ni2+=NiS+Mn2+,则Mn2+与Ni2+离子的物质的量浓度之比=c(Mn2+):c(Ni2+)=Ksp(MnS):Ksp(NiS)=2.8×10-10:2.0×10-21=1.4×1011;
(5)在适当条件下,在MnSO4电解在阳极失去电子获得MnO2,其阳极电极反应式为:Mn2++2H2O-2e-═MnO2+4H+;
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Ni、Co、Mn的化合价分别为+2、+3、+4.当x=y=![]() 时,该化合物中各元素的化合价代数和为0,+1+(+2)×
时,该化合物中各元素的化合价代数和为0,+1+(+2)×![]() +(+3)×
+(+3)×![]() +(+4)×z+(-2)×2=0,z=
+(+4)×z+(-2)×2=0,z=![]() 。
。


科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4.考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
![]()
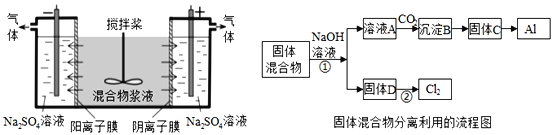
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)C→Al的制备方法称为电解法,请写出阳极反应方程式_____________________.
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2.由此判断影响该反应有效进行的因素有(填序号)_____。
A.温度 B.溶液的pH值 C.Cl-和![]() -的浓度
-的浓度
(3)固体D是碱性锌锰电池的正极,请写出该电池的负极反应方程式_____________ 。
(4)0.2molCl2与焦炭、TiO2完全反应,生成CO和TiCl4(熔点-25℃,沸点136.4℃)放热8.56kJ,该反应的热化学方程式为______________________________________.
Ⅱ.含铬元素溶液的分离和利用
(5)用惰性电极电解时,![]() 能从浆液中分离出来的原因是_________________,
能从浆液中分离出来的原因是_________________,
分离后得到的含铬元素的粒子有![]() ﹣和
﹣和![]() ﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对相应有机物的描述完全正确的是( )
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④油脂:属于高分子化合物,可以发生水解反应
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥糖类、油脂、蛋白质:人类必需的三大营养物质
⑦聚酯纤维、碳纤维、光导纤维:都属于有机高分子材料.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中 A 和 F 中装有乙醇和浓硫酸的混合液,D 中的试管里装有液溴。A 中可能存在的副反应有:①乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚。②温度过高产生 CO2(夹持装置已略去)
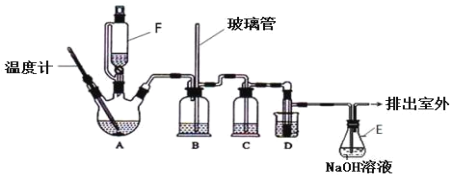
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
填写下列空白:
(1)A 中发生的主反应的化学方程式:_____;
(2)D 中发生反应的化学方程式为:_____。
(3)安全瓶 B 可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶 B 中的现象_____。
(4)在装置 C 中应加入_____,其目的是吸收反应中可能生成的酸性气体。
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(5)容器 E 中 NaOH 溶液的作用是_____。
(6)若产物中有少量副产物乙醚,可用_____(填操作名称)的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
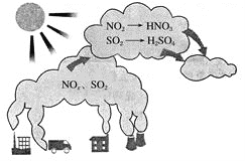
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
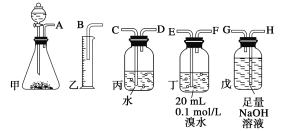
(1)进行实验时,所制气体从左向右流,仪器的正确连接顺序是________________(填接口字母);
(2)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用__________;
(3)若没有除H2S的装置,测定结果将会__________(填“偏高”、“偏低”或“不变”),理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
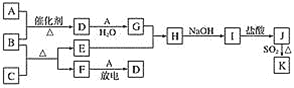
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应:2A(g)+B(g)![]() 3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
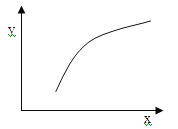
选项 | x | y |
A | A的浓度 | 平衡常数K |
B | 温度 | 混合气体的密度 |
C | B的物质的量 | A的转化率 |
D | 催化剂的质量 | C的体积分数 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用焦炭与SiO2反应可制得粗硅,反应的化学方程式为__,该反应中有元素化合价升高的物质是__,(填化学式,下同),氧化剂是___。
(2)由粗硅制纯硅过程如下:Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯),请写出上述过程中有关反应的化学方程式__,__。
Si(纯),请写出上述过程中有关反应的化学方程式__,__。
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0gSiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为__,硅酸盐的物质的量浓度为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com