
【题目】下列对相应有机物的描述完全正确的是( )
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④油脂:属于高分子化合物,可以发生水解反应
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥糖类、油脂、蛋白质:人类必需的三大营养物质
⑦聚酯纤维、碳纤维、光导纤维:都属于有机高分子材料.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】D
【解析】
①甲烷为天然气的主要成分,光照下与氯气等能发生取代反应,如甲烷与氯气发生取代反应生成氯代烃,故正确;
②乙烯为一个国家石油化工发展水平的标志,含碳碳双键可以发生加成反应,如乙烯与溴水发生加成反应,故正确;
③苯为平面结构,不含碳碳双键,其中的碳碳键是介于单键与双键之间特殊的化学键,故错误;
④油脂的相对分子质量在10000以下,不是高分子,但可水解,故错误;
⑤淀粉为多糖,遇碘单质变蓝色,不是碘元素,故错误;
⑥糖类、油脂、蛋白质均为人类必需的营养物质,为人类生命活动提供能量,故正确;
⑦碳纤维为C的单质,光导纤维的成分为二氧化硅,均为无机材料,只有聚酯纤维为有机高分子材料,故错误;
故选D。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学计量是化学学习的工具,请回答下列问题:
(1)标准状况下,1.7gNH3与__LH2S气体含有的氢原子数相同。
(2)VmLAl2(SO4)3溶液中含Al3+ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是___mol/L。
(3)常温常压下22.4LCO2中分子个数__64克SO2的分子个数(填“>”、“<”或“=”)。
(4)标准状况下,33.6L的NH3所含电子的物质的量约为__mol。
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为__。
(6)某盐混合溶液含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=___。
(7)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为___,NH3的体积分数(即NH3的体积与混合气体总体积的比值)为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)乙醇分子中C原子的杂化方式是_________
(4)[Cu(NH3)4]2+中,提供孤对电子的是________,Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是_______(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是_________。
(5)硫元素对应的含氧酸酸性是H2SO4
强于H2SO3,其原因为___________________。
(6)铜的一种氧化物晶体结构如图所示,
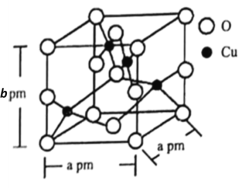
该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由苯乙烯经下列反应可制得B、H两种高分子化合物,它们都是常用的塑料。
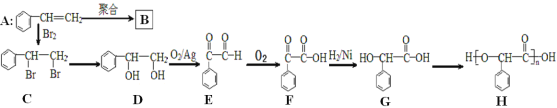
(1)G中所含官能团的名称为_____。
(2)聚合物B的结构简式是________;E的分子式是______________。
(3)C转化为D的化学方程式是_______________(应注明条件); F转化为G的反应类型属于______。
(4)写出G的一种符合下列条件的同分异构体X结简式_______________。
①X与FeCl3 溶液反应显色,也能发生银镜反应和水解反应,②X分子苯环上只有两个互为对位的取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为海水综合利用的部分流程,下列有关说法错误的是( )
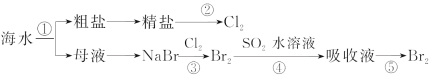
A.实验室进行①的操作需要用到坩埚、玻璃棒、酒精灯
B.②是一个将电能转化为化学能的过程
C.③④⑤涉及的反应均为氧化还原反应
D.④中反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y 和 Z 三种元素的原子序数之和等于 42。X 元素原子的 4p 轨道上有 3 个未成对电子,Y 元素原子的最外层 2p 轨道上有 2 个未成对电子。X 与 Y 可形成化合物X2Y3 ,Z 元素可形成负一价离子。下列说法正确的是( )
A.X 元素基态原子的电子排布式为[Ar]4s2 4p3
B.X 元素是第 4 周期第 VA 族元素
C.Z 元素的单质在氧气中不能燃烧
D.Y 元素基态原子的轨道表示式为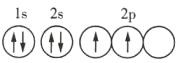
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
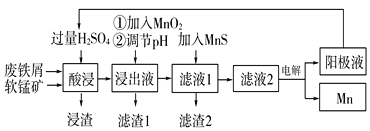
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为
(已知NO+NO2+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO3+NaNO2+H2O)
A.0.8molB.0.6molC.0.2molD.1.0mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com