
����Ŀ��ͭ���������緢�ֲ��㷺ʹ�õ�һ�ֽ�����������ͭ��Һ����εμ�ϡ��ˮ��������ɫ�����������μ�ϡ��ˮ�������ܽ⣬��Һ���ձ�Ϊ����ɫ����������ɫ��Һ�м�����ˮ�Ҵ�������[Cu(NH3)4]SO4��H2O���ش��������⣺
(1)��̬Cuԭ���У������ں����Ų���ԭ�ӹ������________����
(2)N��O��SԪ�ص�ԭ�ӶԼ��ϵ���������������_________��
(3)�Ҵ�������Cԭ�ӵ��ӻ���ʽ��_________
(4)[Cu(NH3)4]2+�У��ṩ�¶Ե��ӵ���________,Cu(NH3)2Cl2������ͬ���칹�壬����һ�ֿ�����ˮ������ֻ�������_______(���������������Ǽ�����)���ӣ��ɴ���֪[Cu(NH3)4]2+�Ŀռ乹����_________��
(5)��Ԫ�ض�Ӧ�ĺ�����������H2SO4
ǿ��H2SO3����ԭ��Ϊ___________________��
(6)ͭ��һ�������ᄃ��ṹ��ͼ��ʾ��
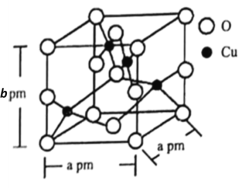
��������Ļ�ѧʽ��________�����þ���ṹΪ�����壬�������ͼ�������ӵ�����ΪNA�������������ܶ�Ϊ_______g��cm��3��
���𰸡�15 O sp3 NH3 ���� ƽ�������� H2SO4��H2SO3�ֱ�ɱ�ʾΪ(HO)2SO2�ͣ�HO��2SO��ǰ�߷��ǻ�����2�������ں��ߵķ��ǻ�����1��������Ŀ��ʹH2SO4�е�S-O-H��O�ĵ��Ӹ�ƫ����S��Խ�������H+�����Ը�ǿ CuO ![]()
��������
��1��ͭ��29��Ԫ�أ�������ӵ��Ų�Ϊ1s22s22p63s23p63d104s1��s�ܼ�һ�������p�ܼ�3�������d�ܼ�5�������ԭ�ӹ����15�������
��2��ԭ�ӶԼ��ϵ���������ȡ����Ԫ��ԭ�ӵĵ縺�Դ�С������Ԫ�ص縺�Ե������ڱ��еĹ��ɣ�ͬһ���ڣ��������ң��縺����ǿ��ͬһ���壬���ϵ��£��縺�Լ�������N��O��S���У��縺����ǿ����O�����ԶԼ��ϵ���������������O��
��3���Ҵ�������Cԭ�Ӷ��γ�4���������µ��Ӷԣ��ӻ���ʽ��sp3��
��4��[Cu��NH��4]2+�У�ͭ�����ṩ�չ�������������еĵ�Ԫ���ṩ�µ��Ӷԣ�Cu��NH3��2Cl2��ͬ���칹�������ˮ��������������ԭ����ˮ�Ǽ��Է��ӣ����Ը÷���Ӧ��Ϊ���Է��ӣ���Ȼ��������ͬ���칹�壬����[Cu��NH��4]2+�Ŀռ乹��Ӧ����ƽ���ı��Σ�
��5����Ԫ�ض�Ӧ�ĺ�����������H2SO4ǿ��H2SO3����ԭ��ΪH2SO4��H2SO3�ֱ�ɱ�ʾΪ(HO)2SO2�ͣ�HO��2SO��ǰ�߷��ǻ�����2�������ں��ߵķ��ǻ�����1��������Ŀ��ʹH2SO4�е�S-O-H��O�ĵ��Ӹ�ƫ����S��Խ�������H+�����Ը�ǿ��
��6����ͼ��ʾ�����ݾ�̯�����Լ����Cuȫ�������ڣ�4����O�ڶ��㡢���ϡ����Ϻ����ģ���8��![]() +2��
+2��![]() +4��
+4��![]() +1=4������ͭ���������������Ϊ1��1�����Ի�ѧʽΪCuO�������ܶ���=
+1=4������ͭ���������������Ϊ1��1�����Ի�ѧʽΪCuO�������ܶ���=![]() =
=![]() ��
��


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��һ����Ҫ�Ļ���ԭ�ϣ���AΪ��Ҫ��ʼԭ�ϣ�ͨ������;�����Ժϳɸ߷��Ӳ�
��PA��PC��
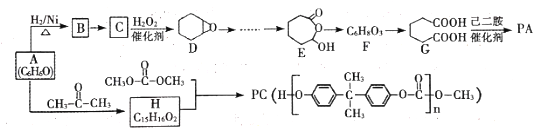
�Իش���������
(1)B�Ļ�ѧ����Ϊ________��B��C�ķ�Ӧ������_____________��
(2)E��F�ķ�Ӧ����Ϊ__________���߷��Ӳ���PA�Ľṹ��ʽΪ________��
(3)��A����H�Ļ�ѧ����ʽΪ______________________��
(4)ʵ���Ҽ����л���A����ѡ�������Լ��е�_____________��
a������ b��FeCl3��Һ C�� NaHCO3��Һ d��Ũ��ˮ
(5)E��ͬ���칹�У�������̼��������Һ��Ӧ�����ܷ���������Ӧ���л��ﹲ��_____�֡����к˴Ź�����гͼ��5��壬�ҷ����֮��Ϊ6��1��1��1��1�����ʵĽṹ��ʽΪ____��
(6)��Bͨ��������Ӧ�Ʊ�1��3��������ϩ�ĺϳ�·��Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���������
A.��״���£�������Ȼ�ϵ�������һ����̼���干8.96L�������������г��ȼ��ʱ���������ķ�����Ϊ0.2NA
B.�ö��Ե缫�������ͭ��Һʱ������Һ��pHֵ��Ϊ1ʱ����缫��ת�Ƶĵ�����ĿΪNA
C.32.5 gп��һ����Ũ����ǡ����ȫ��Ӧ����������ķ�����Ϊ0.5NA
D.��Ӧ3H2(g)��N2(g)![]() 2NH3(g)����H����92 kJ��mol��1�����ų�����9.2 kJʱת�Ƶ���0.6NA
2NH3(g)����H����92 kJ��mol��1�����ų�����9.2 kJʱת�Ƶ���0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ャҺ����Al(OH)3��MnO2������Na2CrO4�����ǵ��������������ʹNa2CrO4������ȫ��ˮ������ij�о�С��������Ƶĵ�����װ�ã���ͼ����ʹ��Һ����ɹ�������ͺ���Ԫ����Һ�����������á��ش��������е����⡣
![]()
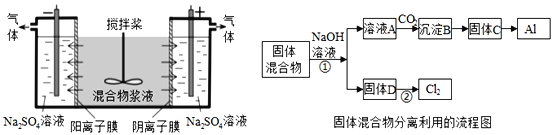
������������ķ�������ã�����ͼ�еIJ��ַ�������ͷ�Ӧ����δ������
��1��C��Al���Ʊ�������Ϊ��ⷨ����д��������Ӧ����ʽ_____________________��
��2����С��̽����Ӧ��������������D��Ũ�����ϣ��������ޱ仯��������Cl2���ɣ�����Ӧֹͣ������ʣ�࣬��ʱ�μ����ᣬ�ֲ���Cl2���ɴ��ж�Ӱ��÷�Ӧ��Ч���е������У�����ţ�_____��
A���¶� B����Һ��pHֵ C��Cl-��![]() -��Ũ��
-��Ũ��
��3������D�Ǽ���п�̵�ص���������д���õ�صĸ�����Ӧ����ʽ_____________ ��
��4��0.2molCl2�뽹̿��TiO2��ȫ��Ӧ������CO��TiCl4���۵�-25��,�е�136��4��������8.56kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ______________________________________��
��������Ԫ����Һ�ķ��������
��5���ö��Ե缫���ʱ��![]() �ܴӽ�Һ�з��������ԭ����_________________��
�ܴӽ�Һ�з��������ԭ����_________________��
�����õ��ĺ���Ԫ�ص�������![]() ����
����![]() ����ԭ����__________________________(�����ӷ�Ӧ����ʽ��ʾ)�����������ɵ�����Ϊ_____________��д��ѧʽ����
����ԭ����__________________________(�����ӷ�Ӧ����ʽ��ʾ)�����������ɵ�����Ϊ_____________��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ļ�����ϳɡ�Ӧ���Լ��Ի�����Ӱ��һֱ�ǿ�ѧ���о����ȵ㡣
(1)������Ҫ��NH3��CO2Ϊԭ�Ͻ��кϳɡ���Ҫͨ������������Ӧ����:
��Ӧ1��2NH3(l)+CO2(g)![]() H2NCOONH4(l)����H1= -117.2 kJ��mol-1
H2NCOONH4(l)����H1= -117.2 kJ��mol-1
��Ӧ2��H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l)����H2=+21.7 kJ��mol-1
H2O(l)+CO(NH2)2(l)����H2=+21.7 kJ��mol-1
��ش�CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ��H3=_____________���÷�Ӧ���Է����е���Ҫԭ����__________________��
2NH3(l)+CO2(g) ��H3=_____________���÷�Ӧ���Է����е���Ҫԭ����__________________��
(2)��̿����ԭSO2����S2����ѧ����ʽΪ��2C(s)+2SO2(g)![]() S2(g)+2CO2(g)���ں��������У�1 mol/LSO2�������Ľ�̿��Ӧ��SO2��ת�������¶ȵı仯��ͼ��ʾ��
S2(g)+2CO2(g)���ں��������У�1 mol/LSO2�������Ľ�̿��Ӧ��SO2��ת�������¶ȵı仯��ͼ��ʾ��
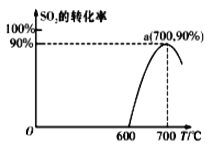
����700�������÷�Ӧ����3���Ӵﵽƽ�⣬����0��3����v(S2)=_______molL-1min-1�����¶��µ�ƽ�ⳣ��Ϊ_________��
�����÷�Ӧ����ʼ�¶�Ϊ700���ĺ��ݾ��������н��У��ﵽƽ��ʱSO2��ת����________90%(��������������������=��)��
������˵��һ����˵���÷�Ӧ�ﵽƽ��״̬����_______��
A����̿���������ٱ仯ʱ
B��CO2��SO2��Ũ�����ʱ
C��SO2������������CO2����������֮��Ϊ1:1
D����������ѹǿ���ٱ仯ʱ
(3) NO2��O2������KNO3������ȼ�ϵ�أ���ԭ����ͼ��ʾ��

ʯīI���������ķ�ӦΪ__________________________________�������·ͨ��1mole-�������Ϲ�����_______mol N2O5 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����

ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | ϡ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | KMnO4 | Cl2 | NaOH��Һ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں���������ʵ���Һ�У������ж����ѧƽ��档
��1��һ���¶��£���1L0.1molL��1CH3COOH��Һ�м���0.1molCH3COONa���壬ƽ�������Һ��![]() ___�����������С�����䡱����д����ʾ�û����Һ����������Ũ�ȼ��һ����ʽ��______
___�����������С�����䡱����д����ʾ�û����Һ����������Ũ�ȼ��һ����ʽ��______
��2����������20mL 0.1molL��1Na2CO3��Һ����μ���0.1molL��1HCl��Һ40mL����Һ�к�̼Ԫ�صĸ�������CO2���ݳ�δ���������ʵ�����������ҺpH�仯��������£�
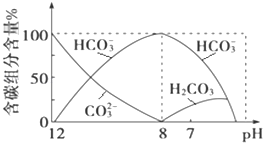
�ش��������⣺
����ͬһ��Һ�У�H2CO3��HCO3����CO32��___����ܡ����ܡ����������棻
�ڵ�pH��7ʱ����Һ�к�̼Ԫ�ص���Ҫ����_____��___����Һ�к������������������ʵ���Ũ�ȵĴ�С��ϵΪ____��
����֪��25��ʱ��CO32��ˮ�ⷴӦ��ƽ�ⳣ����ˮ�ⳣ��Kh�T2��10��4 molL��1������Һ��c��HCO3������c��CO32������2��1ʱ����Һ��pH��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵������ȷ����
A.��28g��ϩ�����У�һ����ƽ���ԭ����ĿΪ6NA
B.1mol��������(P4)�����������Ĺ��ۼ�����Ϊ4NA
C.25��ʱ��1LpH��1��H2SO4��Һ�к��е�H����Ϊ0.2NA
D.��״���£�22.4L��������������������Һ��Ӧ��ת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���ͬѧΪ����ȡNO��̽�������ʣ�����������ʵ�顣
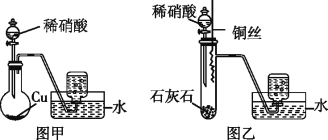
�Իش���������:
(1)ijͬѧ��ͼ��װ�ý���ʵ�飬�ռ�����ɫ���壬�ɴ�ȷ��ͭ��ϡ���ᷴӦ����NO���塣��ͬѧ���ƶϲ�������������__________ (�û�ѧ����ʽ��ʾ)��
(2)��һ��ͬѧ�����ͼ��װ�ý���ʵ�飬��������:���ڴ��Թ��з�������ʯ��ʯ���������ϡ����;����ʯ��ʯ��Ӧ��ȫ����ͭ˿���������ϡ������;��һ��ʱ��۲쵽���Թ�������ʼ��Ϊ��ɫ���ռ���Ӧ���������塣���в�������������___________��
(3)��������ͭ��ϡ������ȫ��Ӧ���ټ�20%��ϡ���ᣬͭƬ���������ݲ�����ϡ�����������___(��ѡ����)����Ӧ�����ӷ���ʽΪ__________��
a.��ԭ�� b.������ c.�ṩ������ d.�ṩ����
(4)ijЩ������ΪNO������Na2O2��Ӧ����ͬѧ������ɣ�����ΪNO����O2������Ӧ��Ӧ�ø����ױ�Na2O2������
��������:a.2NO+Na2O2=2NaNO2
b.6NaNO2+3H2SO4(ϡ)=3Na2SO4+2HNO3+4NO��+2H2O
c.���������£�NO�ܱ�MnO![]() ������NO
������NO![]()
��ͬѧ����ͼ��װ����̽��NO��Na2O2�ķ�Ӧ(װ�ÿ��ظ�ʹ��)��
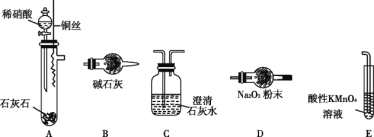
��װ�õ�����˳��ΪA��_________��װ��E�������� __________��
����ַ�Ӧ��������װ��D���Ƿ�������NaNO2�������ʵ�鷽��_________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com