
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 稀硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
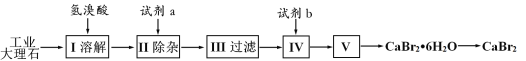
下列说法错误的是
A.已知步骤Ⅲ的滤液中不含NH4+,步骤II加入的试剂a是石灰水
B.步骤II控制溶液的pH约为8.0的主要目的是沉淀过量Ca2+
C.试剂b是氢溴酸,步骤IV的目的是除去过量的氢氧化钙
D.步骤V所含的操作依次是蒸发浓缩,冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45 倍。 | (1)A的相对分子质量为:_____________。 |
(2)将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 | (3)用结构简式表示A 中含有的官能团__________。 |
(4)A的核做共振氢谱如下图:
| (4)A中含有四种氢原子。 |
(5)综上所述,A 的结构简式为__________, 写出两分子A能脱去两分子水形成一种六元环状化合物的化学方程式_______________________________________ (6)A有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1molH2,则该种同分异构体的结构简式为 ____________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜、铁和硫酸铜溶液组成的原电池中,作正极的是_______________,正极的电极反应式为____________________________;作负极的是______________,电子由___________________(填“正”或“负”,下同)极经导线移向________________极,总反应的离子方程式为_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)乙醇分子中C原子的杂化方式是_________
(4)[Cu(NH3)4]2+中,提供孤对电子的是________,Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是_______(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是_________。
(5)硫元素对应的含氧酸酸性是H2SO4
强于H2SO3,其原因为___________________。
(6)铜的一种氧化物晶体结构如图所示,
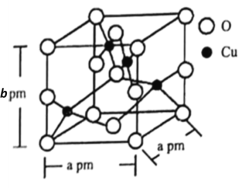
该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐是硫酸盐的一种复盐,是一种重要的化学试剂,它的水溶液中加入KSCN不显红色,并有如图所示的反应:
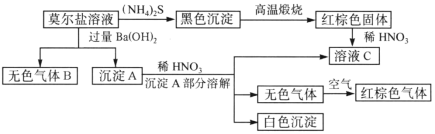
根据以上关系,按要求填空:
(1)可用检验气体B__________________。
(2)莫尔盐的化学式为____________________。
(3)部分沉淀A与稀HNO3反应的离子方程式是_____________________。
(4)古代硫酸的制法是隔绝空气锻烧绿矾(FeSO4·7H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。(已知SO3的熔点是16.8°C,沸点是44.8°C,再加矾受热分解的产物)

①装置的连接顺序为______________。
②B的作用是验证该反应有水生成,其中的试剂为_________,实验过程中发现F中溶液褪色,D中出现无色粘稠液体,则煅烧绿矾的反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,D单质是一种淡黄色固体。请回答:
①C2B2的电子式是___________,D、E可形成化合物DE2中,存在下列哪些静电作用力______。
a.极性键 b.非极性键 c.范德华力 d.氢键 e.离子键
②B、C、E的离子半径由大到小的顺序为_______________(用化学式回答),举一个事实证明E和D非金属性的强弱___________________(用离子反应方程式表示)。
(2)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:

当尿素三聚时,得到两种产物,其中一种为环状结构,请画出其结构式___________。
(3)已知某元素的原子序数是33,试推测该元素:
①原子的原子结构示意图______________。
②在元素周期表中的位置______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒温密闭容器中通入气体X并发生反应:2X(g)![]() Y(g)(正反应放热),X的物质的量n(X)随时间t变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是( )
Y(g)(正反应放热),X的物质的量n(X)随时间t变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是( )
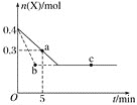
A.实线表示使用催化剂的情形
B.b、c两点表明反应在相应的条件下达到了最大限度
C.反应进行到a点时放出的热量多于反应进行到b点时放出的热量
D.反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三份浓度均为0.1 mol/L,体积均为1 L 的CH3COONa 溶液中分别加入NH4Cl 固体、CH3COONH4固体、HCl 气体后所得溶液pH 变化曲线如图(溶液体积变化忽略不计)下列说法不正确的是
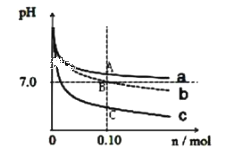
A.曲线 a、b、c 分别代表加入 CH3COONH4、NH4Cl、HCl
B.由图可知 Ka(CH3COOH)=Kb(NH3﹒H2O)=1×10-7
C.A点处 c(CH3COO-)>c(Na+)> c(NH4+)> c(OH-)> c(H+)
D.C点处 c(CH3COO-)+c(Cl-)+c(OH-)>0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com