
【题目】由铜、铁和硫酸铜溶液组成的原电池中,作正极的是_______________,正极的电极反应式为____________________________;作负极的是______________,电子由___________________(填“正”或“负”,下同)极经导线移向________________极,总反应的离子方程式为_________________________。

科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100mol·L-1 NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示:
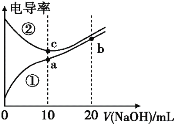
下列说法正确的是
A.曲线②代表滴定盐酸的曲线
B.滴定醋酸的过程应该选择甲基橙作为指示剂
C.a、b、c三点溶液中水的电离程度:a>c>b
D.b点溶液中:c(OH-)=c(H+)+c(CH3COO-)+ c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的反应2SO3(g)O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是( )
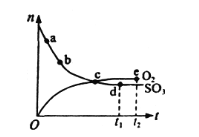
A.点c处反应达到平衡
B.点b的正反应速率比点a的大
C.点e逆反应速率为0
D.一定温度下,2SO3(g) O2(g)+2SO2(g)在恒容密闭容器中进行,充入He,压强增大,化学反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
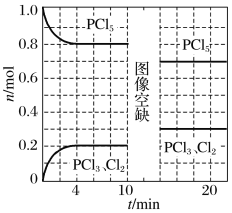
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4.考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
![]()
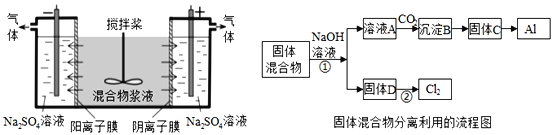
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)C→Al的制备方法称为电解法,请写出阳极反应方程式_____________________.
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2.由此判断影响该反应有效进行的因素有(填序号)_____。
A.温度 B.溶液的pH值 C.Cl-和![]() -的浓度
-的浓度
(3)固体D是碱性锌锰电池的正极,请写出该电池的负极反应方程式_____________ 。
(4)0.2molCl2与焦炭、TiO2完全反应,生成CO和TiCl4(熔点-25℃,沸点136.4℃)放热8.56kJ,该反应的热化学方程式为______________________________________.
Ⅱ.含铬元素溶液的分离和利用
(5)用惰性电极电解时,![]() 能从浆液中分离出来的原因是_________________,
能从浆液中分离出来的原因是_________________,
分离后得到的含铬元素的粒子有![]() ﹣和
﹣和![]() ﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯的盐NaClO2是一种重要的含氯消毒剂。以下是过氧化氢法生产NaClO2的工艺流程图:
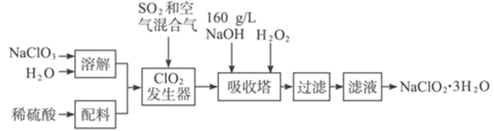
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283 K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
(1)NaClO2 的名称为_______________
(2)ClO2发生器中所发生反应的化学方程式为_______________,发生器中鼓入空气的作用可能是_______________(选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸; c.将NaClO3氧化成ClO2
(3)吸收过程中所用还原剂的还原性应适中,原因是_________,除H2O2外,还可以选择的还原剂是____________(填序号)
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(5)将所得的NaClO2·3H2O晶体用冰水洗涤烘干,如何确定该晶体洗涤干净?
________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 稀硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式__。
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) H<0。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值___(增大、减小),T温度时化学平衡常数K=___mol-1·L
②从0~2s该反应的平均速率v(NO2)=___。
③对可逆反应2NO(g)+O2(g)![]() 2NO2(g) H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___。
2NO2(g) H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.氧气的转化率不再变化
D.N2、O2、NO的物质的量之比为1:1:2
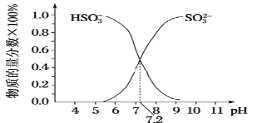
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是___(写出主要反应的离子方程式),该溶液中,c(Na+)___2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是将化学能转化为电能的装置。
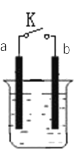
I. a为铜片,b为铁片,烧杯中是稀硫酸溶液
(1)当开关K断开时产生的现象为_______ ;当开关K闭合时,产生的现象为_________。
A.a不断溶解 B.b不断溶解 C.a上产生气泡 D.b上产生气泡 E.溶液逐渐变蓝
(2)闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述不正确的是___________ 。
A.溶液中H+浓度减小 B.正极附近![]() 浓度逐渐增大
浓度逐渐增大
C.溶液中含有FeSO4 D.溶液中![]() 浓度基本不变
浓度基本不变
II.FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为 ________ ,若将此反应设计成原电池,请写出该原电池负极电极反应为_______,正极电极反应为______。
III.如图是氢氧燃料电池构造示意图。
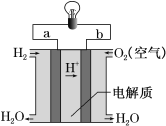
下列说法不正确的是______
A.a极是负极
B.电子由b通过溶液流向a
C.该电池总反应是2H2+O2=2H2O
D.氢氧燃料电池是环保电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com