
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.用惰性电极电解硫酸铜溶液时,若溶液的pH值变为1时,则电极上转移的电子数目为NA
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
【答案】B
【解析】
A.氢气和一氧化碳气体的物质的量为8.96L÷22.4L·mol-1=0.4mol,根据2CO~O2,2H2~O2,可知共消耗O20.2mol,分子数为0.2NA,故A正确;
B.用惰性电极电解硫酸铜溶液时,2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,若溶液的pH值变为1时,没有提供溶液的体积,无法计算生成的硫酸的物质的量,故B错误;
2Cu+O2↑+2H2SO4,若溶液的pH值变为1时,没有提供溶液的体积,无法计算生成的硫酸的物质的量,故B错误;
C. 32.5 g锌的物质的量为0.5mol,完全反应变成锌离子失去1mol电子;与浓硫酸完全反应,无论生成二氧化硫还是生成氢气,每生成1个气体分子达到2个电子,所以转移1mol电子会生成0.5mol气体,生成气体分子数为0.5NA,故C正确;
D. 反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时,参加反应的氢气为0.3mol,转移电子0.6NA,故D正确;
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时,参加反应的氢气为0.3mol,转移电子0.6NA,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线:
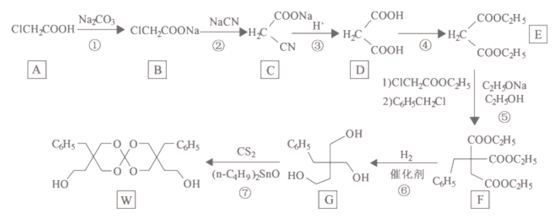
回答下列问题
(1)②的反应类型是________________。
(2)D的系统命名为____________________。
(3)反应④所需试剂,条件分别为__________________。
(4)G的分子式为___________,所含官能团的名称是_______________。
(5)写出与E互为同分异构体且满足下列条件的酯类化合物的结构简式__________(核磁共振氢谱为两组峰,峰面积比为1∶1)。
(6)苯乙酸苄酯(![]() )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线___________________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线___________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
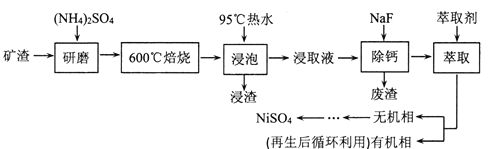
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
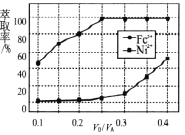
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
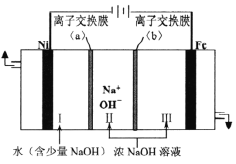
①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。H2O2能与SO2反应生成H2SO4, H2O2的分子结构如图所示。下列说法错误的是( )

A. H2O2的结构式为H—O—O—H
B. H2O2为含有极性键和非极性键的共价化合物
C. 与SO2在水溶液中反应的离子方程式为SO2+ H2O2=2H++SO42-
D. H2O2与SO2反应过程中有共价键断裂,同时有共价键和离子键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烷烃分子中含共价键的数目为16,则该烷烃的分子式为____________,其一氯代物只有一种的烷烃的结构简式为_____________。
(2)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
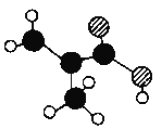
①该物质的结构简式为________________。
②下列物质中,与该物质互为同系物的是(填序号)__________,互为同分异构体的是________。
A.CH3CH=CHCOOH B.CH2=CHCOOCH3
C.CH3CH2CH=CHCOOH D.CH3CH(CH3)COOH
(3)药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。
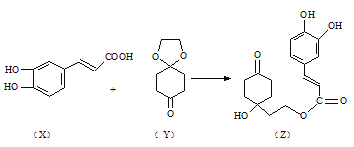
试填空:
① X的分子式为_____________ ;该分子中最多共面的碳原子数为___________ 。
②Y中是否含有手性碳原子______________(填“是”或“否”)。
③1molZ与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠______________mol;1molZ与足量的浓溴水充分反应,需要消耗Br2_____________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45 倍。 | (1)A的相对分子质量为:_____________。 |
(2)将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 | (3)用结构简式表示A 中含有的官能团__________。 |
(4)A的核做共振氢谱如下图:
| (4)A中含有四种氢原子。 |
(5)综上所述,A 的结构简式为__________, 写出两分子A能脱去两分子水形成一种六元环状化合物的化学方程式_______________________________________ (6)A有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1molH2,则该种同分异构体的结构简式为 ____________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )
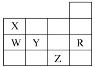
A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)乙醇分子中C原子的杂化方式是_________
(4)[Cu(NH3)4]2+中,提供孤对电子的是________,Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是_______(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是_________。
(5)硫元素对应的含氧酸酸性是H2SO4
强于H2SO3,其原因为___________________。
(6)铜的一种氧化物晶体结构如图所示,
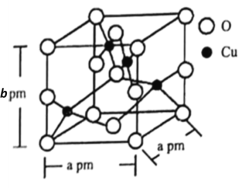
该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技创新的产品设备在工作时有化学能转变成电能的是( )
A. [Failed to download image : http://192.168.0.10:8086/QBM/2019/6/24/2232583815659520/2233878409273344/STEM/470d05a5dd2448b794aa06c917ec6f19.png]长征5号火箭使用的液氧煤油发动机
B.  北斗导航卫星的太阳能电池板
北斗导航卫星的太阳能电池板
C.  位于江苏的海上风力发电厂
位于江苏的海上风力发电厂
D.  世界首部可折叠柔屏手机
世界首部可折叠柔屏手机
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com