
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )
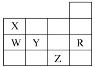
A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是( )
A. 反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B. 上述转化中包含了氨气、硝酸、硝铵、小苏打、纯碱的工业生产方法
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D. H3PO2溶于水的电离方程式为H3PO2![]() H++ H2PO2-
H++ H2PO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知密闭容器中进行的合成氨反应为N2+3H2![]() 2NH3,该反应为放热反应。下列判断正确的是( )
2NH3,该反应为放热反应。下列判断正确的是( )
A. 1 mol N2和3 mol H2的能量之和与2 mol NH3具有的能量相等
B. 反应过程中同时有1.5 mol H—H键、3 mol N—H键断裂时,N2的浓度维持不变
C. 降低NH3的浓度,正反应速率增大,逆反应速率减小
D. 当反应速率满足v(N2)∶v(H2)=1∶3时,反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
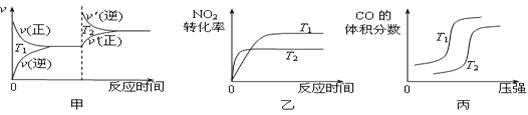
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;
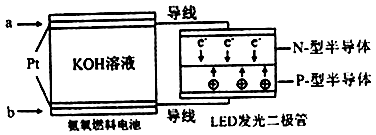
请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 2 mol水的摩尔质量为36g/mol
B. 摩尔是用来衡量微观粒子多少的一种物理量
C. 阿伏加德罗常数约为6.02×1023mol-1
D. 1mol·L-1的Na2SO4溶液中,含Na+的个数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com