
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
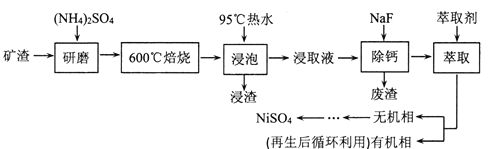
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
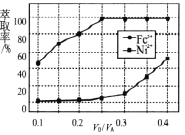
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
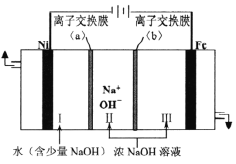
①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
【答案】SiO2 4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O 99% 0.25 强酸性 Fe-6e-+8OH-=FeO42-+4H2O 阴 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600℃焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用,据此分析解答。
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用。
(1)矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的硫酸钙和二氧化硅,“浸渣”的成分除Fe2O3、FeO(OH)、CaSO4外,还含有SiO2;
(2)矿渣中部分FeO焙烧时与H2SO4及空气中的氧气反应生成Fe2(SO4)3和水,反应的化学方程式为4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O;
(3)当溶液中c(F-)=2.0×10-3mol·L-1时,Ksp(CaF2)=c(Ca2+)×c2(F-)= c(Ca2+)×(2.0×10-3mol·L-1)2=4.0×10-11,故c(Ca2+)=1.0×10-5mol/L,则除钙率为![]() 99%;
99%;
(4)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图象,最佳取值为0.25;在强酸性介质中“反萃取”能使有机相再生而循环利用;
(5)①电解时正极连接铁电极,为阳极,阳极上失电子在碱性条件下反应生成FeO42-,电极反应式为Fe-6e-+8OH-=FeO42-+4H2O;离子交换膜(b))允许氢氧根离子向Ⅲ移动,为阴离子交换膜;
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。次氯酸钠将氢氧化铁氧化生成高铁酸钠,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。


科目:高中化学 来源: 题型:
【题目】关于下列两种物质的说法,正确的是
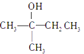
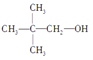
A. 核磁共振氢谱都有3个吸收峰
B. 都不能发生消去反应
C. 都能与Na反应生成H2
D. 都能在Cu作催化剂时发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),一定条件下测得反应过程中n(Cl2)与时间的关系如表所示:则4~6min内用O2的物质的量变化表示的反应速率是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(Cl2)/mol | 0 | 1.2 | 2.6 | 4.4 | 5.4 | 6.0 |
A.7.2molmin-1B.8.0molmin-1C.0.9molmin-1D.0.45molmin-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的化工原料,以A为主要起始原料,通过下列途径可以合成高分子材
料PA及PC。
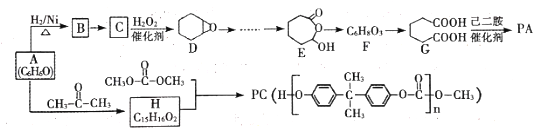
试回答下列问题
(1)B的化学名称为________,B到C的反应条件是_____________。
(2)E到F的反应类型为__________,高分子材料PA的结构简式为________。
(3)由A生成H的化学方程式为______________________。
(4)实验室检验有机物A,可选择下列试剂中的_____________。
a.盐酸 b.FeCl3溶液 C. NaHCO3溶液 d.浓溴水
(5)E的同分异构中,既能与碳酸氢钠溶液反应、又能发生银镜反应的有机物共有_____种。其中核磁共振氢谐图有5组峰,且峰面积之比为6:1:1:1:1的物质的结构简式为____。
(6)由B通过三步反应制备1.3-环己二烯的合成路线为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
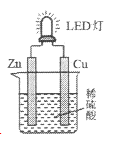
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子化合物的结构如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W的最低负价与Y的最高正价代数和为0,X与Z同主族。下列说法不正确的是
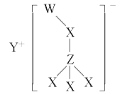
A.Y、Z组成的化合物水溶液呈碱性B.原子半径大小:Z>Y>X>W
C.W、Y组成的化合物有强还原性D.最简单氢化物的稳定性:X>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A.0.5mol羟基中所含电子数为5NA
B.标况下,11.2LCHCl3中,共用电子对的数目为2NA
C.2.8g的乙烯和丙烯(C3H6)中含有的碳原子数为0.2NA
D.1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4NA
)分子中含有碳碳双键的个数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.用惰性电极电解硫酸铜溶液时,若溶液的pH值变为1时,则电极上转移的电子数目为NA
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L0.1molL﹣1CH3COOH溶液中加入0.1molCH3COONa固体,平衡后则溶液中![]() ___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
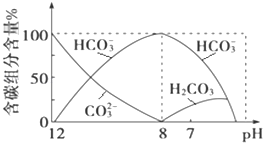
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
回答下列问题:
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣___(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有_____、___,溶液中含量最多的三种微粒的物质的量浓度的大小关系为____;
③已知在25℃时,CO32﹣水解反应的平衡常数即水解常数Kh═2×10﹣4 molL﹣1,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,溶液的pH=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com