
【题目】某离子化合物的结构如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W的最低负价与Y的最高正价代数和为0,X与Z同主族。下列说法不正确的是
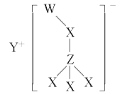
A.Y、Z组成的化合物水溶液呈碱性B.原子半径大小:Z>Y>X>W
C.W、Y组成的化合物有强还原性D.最简单氢化物的稳定性:X>Z
【答案】B
【解析】
W、X、Y、Z是原子序数依次增大的短周期主族元素,W的最低负价与Y的最高正价代数和为0,X与Z同主族。由离子结构可知,Y易失去1个电子,Z与X之间形成4个共价键,X与其他元素之间形成2个共价键,W与X之间只有一个共价键,说明W为氢元素,X为氧元素,Z为硫元素,Y为钠元素。
A. Y、Z组成的化合物为硫化钠,是强碱弱酸盐,水溶液呈碱性,A正确;
B. 原子半径同周期,从左到右依次减小;同主族,从上到下依次增大,即大小:Y > Z >X>W,B错误;
C. W、Y组成的化合物为NaH,H为-1价,具有强还原性,有强还原性,C正确;
D. 最简单氢化物的稳定性与非金属性有关,非金属性越强,稳定性越强,X>Z,D正确;
答案为B。


科目:高中化学 来源: 题型:
【题目】实验室模拟从海带提取碘单质的流程,下列有关说法正确的是
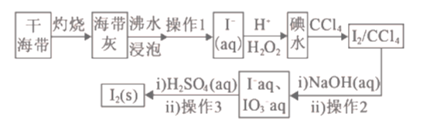
A.实验室在蒸发皿中灼烧干海带
B.操作1为过滤,操作3为蒸馏H2SO4(aq)
C.含I-的滤液中加入稀硫酸和H2O2后,碘元素发生还原反应
D.含I-和IO3-的混合溶液中加入稀硫酸发生反应的离子方程式为:5I-+IO3-+6H+=3I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。
(1)Y的元素符号为________,Z在周期表中的位置为________;
(2)写出化合物WZX的电子式_________;
(3)实验室制取Y的简单氢化物的化学方程式为________;
(4)W2Z2可作供氧剂,当有O.1molO2生成时转移的电子数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
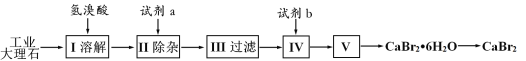
下列说法错误的是
A.已知步骤Ⅲ的滤液中不含NH4+,步骤II加入的试剂a是石灰水
B.步骤II控制溶液的pH约为8.0的主要目的是沉淀过量Ca2+
C.试剂b是氢溴酸,步骤IV的目的是除去过量的氢氧化钙
D.步骤V所含的操作依次是蒸发浓缩,冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
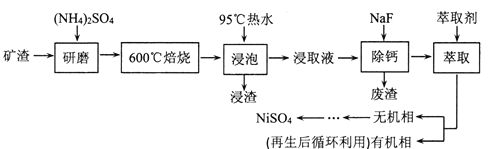
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
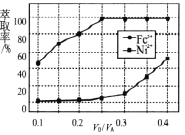
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
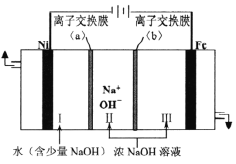
①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C,向20mL 0.1mol·L-1的H2A溶液中滴加0.1mol·L-1的KOH溶液,滴定曲线如图,下列说法不正确的是

A.H2A的电离方程式:H2AH++HA-,HA-H++A2-
B.X点溶液中:c(HA-)+c(H2A)+c(A2-)=0.1 mol·L-1
C.Z点溶液中存在关系c(K+)=c(HA-)+2c(A2-)
D.W点时,c(K+)>c(OH-)>c(HA-)>c(H2A)>c(A2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。H2O2能与SO2反应生成H2SO4, H2O2的分子结构如图所示。下列说法错误的是( )

A. H2O2的结构式为H—O—O—H
B. H2O2为含有极性键和非极性键的共价化合物
C. 与SO2在水溶液中反应的离子方程式为SO2+ H2O2=2H++SO42-
D. H2O2与SO2反应过程中有共价键断裂,同时有共价键和离子键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45 倍。 | (1)A的相对分子质量为:_____________。 |
(2)将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 | (3)用结构简式表示A 中含有的官能团__________。 |
(4)A的核做共振氢谱如下图:
| (4)A中含有四种氢原子。 |
(5)综上所述,A 的结构简式为__________, 写出两分子A能脱去两分子水形成一种六元环状化合物的化学方程式_______________________________________ (6)A有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1molH2,则该种同分异构体的结构简式为 ____________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,D单质是一种淡黄色固体。请回答:
①C2B2的电子式是___________,D、E可形成化合物DE2中,存在下列哪些静电作用力______。
a.极性键 b.非极性键 c.范德华力 d.氢键 e.离子键
②B、C、E的离子半径由大到小的顺序为_______________(用化学式回答),举一个事实证明E和D非金属性的强弱___________________(用离子反应方程式表示)。
(2)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:

当尿素三聚时,得到两种产物,其中一种为环状结构,请画出其结构式___________。
(3)已知某元素的原子序数是33,试推测该元素:
①原子的原子结构示意图______________。
②在元素周期表中的位置______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com