
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A.0.5mol羟基中所含电子数为5NA
B.标况下,11.2LCHCl3中,共用电子对的数目为2NA
C.2.8g的乙烯和丙烯(C3H6)中含有的碳原子数为0.2NA
D.1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4NA
)分子中含有碳碳双键的个数为4NA
科目:高中化学 来源: 题型:
【题目】企鹅酮的化学式C10H14O,因为结构类似企鹅,因此命名为企鹅酮(见图)。下列有关企鹅酮的说法正确的是

A.分子式为C10H16O
B.1 mol企鹅酮分子最多可以和2 mol氢气加成
C.可使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
D.企鹅酮的同分异构体众多,其中遇Fe3+显色且苯环上有两个支链的结构共有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中化学键如图: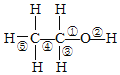
⑴与金属钠反应时,键_________断裂;
⑵与浓硫酸共热制乙烯时,键________断裂;
⑶催化氧化为醛时,键______断裂,
⑷与乙酸、浓硫酸混合制乙酸乙酯,键_____断裂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
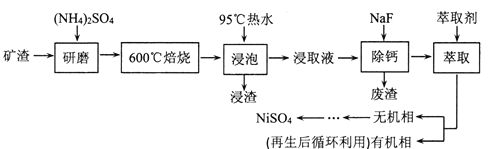
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
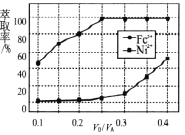
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
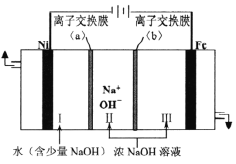
①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是_______。(填“Ⅰ”“Ⅱ”或“Ⅲ”)
①M为钠,则实验过程中烧杯中可观察到的现象是__________________;
②观察到烧杯里产生气泡,则说明M溶于水______(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是_____________________________;
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是_______________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是________________,说明该反应属于______(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热量变化情况,选择装置Ⅱ进行实验(在甲中进行)。M为钠,则实验过程中烧杯中可观察到的现象是_________________;
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置__________(填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。H2O2能与SO2反应生成H2SO4, H2O2的分子结构如图所示。下列说法错误的是( )

A. H2O2的结构式为H—O—O—H
B. H2O2为含有极性键和非极性键的共价化合物
C. 与SO2在水溶液中反应的离子方程式为SO2+ H2O2=2H++SO42-
D. H2O2与SO2反应过程中有共价键断裂,同时有共价键和离子键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烷烃分子中含共价键的数目为16,则该烷烃的分子式为____________,其一氯代物只有一种的烷烃的结构简式为_____________。
(2)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
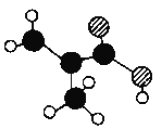
①该物质的结构简式为________________。
②下列物质中,与该物质互为同系物的是(填序号)__________,互为同分异构体的是________。
A.CH3CH=CHCOOH B.CH2=CHCOOCH3
C.CH3CH2CH=CHCOOH D.CH3CH(CH3)COOH
(3)药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。
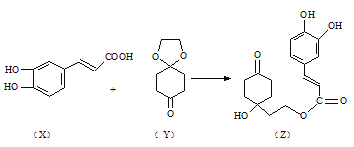
试填空:
① X的分子式为_____________ ;该分子中最多共面的碳原子数为___________ 。
②Y中是否含有手性碳原子______________(填“是”或“否”)。
③1molZ与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠______________mol;1molZ与足量的浓溴水充分反应,需要消耗Br2_____________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )
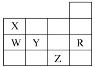
A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素的第一电离能:Al____Si(填“>”或“<”),按电负性由大到小的顺序排列N、O、F___。
(2)基态Mn2+的核外电子排布式为___。
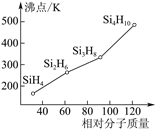
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是___。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
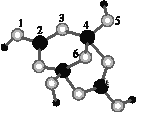
①在Xm-中,硼原子轨道的杂化类型有___;配位键存在于___原子之间(填原子的数字标号)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有___(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力E.氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com