
����Ŀ����1��Ԫ�صĵ�һ�����ܣ�Al____Si(����>������<��)�����縺���ɴ�С��˳������N��O��F___��
��2����̬Mn2+�ĺ�������Ų�ʽΪ___��
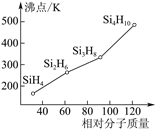
��3������(SinH2n+2)�ķе�������Է��������ı仯��ϵ��ͼ��ʾ���������ֱ仯��ϵ��ԭ����___��
��4����ɰ�Ǻ��ᾧˮ���������ƣ���������Xm-(��B��O��H����Ԫ��)�����ģ����ͼ��ʾ��
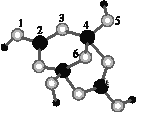
����Xm-�У���ԭ�ӹ�����ӻ�������___����λ��������___ԭ��֮��(��ԭ�ӵ����ֱ��)��
����ɰ������Na+��Xm-��H2O���ɣ�����֮����ڵ���������___(�����)��
A.���Ӽ� B.���ۼ� C.������ D.���»���E.���
���𰸡�< F��O��N 1s22s22p63s23p63d5(��[Ar]3d5) �������Է�������Խ���Ӽ䷶�»���Խǿ sp2��sp3 4��5(��5��4) ABDE
��������
(1)ͬ���ڴ����ҵ�һ���������������ƣ�����A�͵���A������ͬ����Ԫ�أ������ҵ縺����ǿ��
(2)Mn�ĵ����Ų�ʽΪ1s22s22p63s23p63d54s2��[Ar]3d54s2��
(3)�����Ƿ��Ӿ��壬�ṹ���ƣ���Է�������Խ���Ӽ�ķ��»���Խ�е�Խ�ߣ�
(4)��1��3��5��6������ԭ�ӣ�2��4����Bԭ�ӣ�2��B�γ�3��������Bԭ��Ϊsp2�ӻ���4��B�γ�4��������Bԭ��Ϊsp3�ӻ��� Bһ�����γ�3������4��B�γ�4����������1�����ܿ��ܾ�����λ������λ������4����5��֮�䣻
����������Xm-�γ����Ӽ���ˮ�����ɹ��ۼ��γɣ��ᾧˮ���Ӽ��������ͷ��»�����
(1)ͬ���ڴ����ҵ�һ���������������ƣ�����A�͵���A�������������ĵ�һ������С�ڹ�ģ�ͬ����Ԫ�أ������ҵ縺����ǿ��N��O��F�縺���ɴ�С��˳����F��O��N ���ʴ�Ϊ������F��O��N ��
(2)Mn�ĵ����Ų�ʽΪ1s22s22p63s23p63d54s2��[Ar]3d54s2�����̬Mn2+�ĺ�������Ų�ʽΪ1s22s22p63s23p63d5��[Ar]3d5���ʴ�Ϊ��1s22s22p63s23p63d5(��[Ar]3d5)��
(3)�����Ƿ��Ӿ��壬�ṹ���ƣ���Է�������Խ���Ӽ�ķ��»���Խ�е�Խ�ߣ��ʴ�Ϊ���������Է�������Խ���Ӽ䷶�»���Խǿ��
(4)��1��3��5��6������ԭ�ӣ�2��4����Bԭ�ӣ�2��B�γ�3��������Bԭ��Ϊsp2�ӻ���4��B�γ�4��������Bԭ��Ϊsp3�ӻ��� Bһ�����γ�3������4��B�γ�4����������1�����ܿ��ܾ�����λ������λ������4����5��֮�䣬�ʴ�Ϊ��sp2��sp3��4��5(��5��4)��
����������Xm-�γ����Ӽ���ˮ�����ɹ��ۼ��γɣ��ᾧˮ���Ӽ��������ͷ��»������ʴ�Ϊ��ABDE��


 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ������������й�˵����ȷ���ǣ� ��
A.0.5mol�ǻ�������������Ϊ5NA
B.����£�11.2LCHCl3�У����õ��ӶԵ���ĿΪ2NA
C.2.8g����ϩ�ͱ�ϩ��C3H6���к��е�̼ԭ����Ϊ0.2NA
D.1mol����ϩ��![]() �������к���̼̼˫���ĸ���Ϊ4NA
�������к���̼̼˫���ĸ���Ϊ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ļ�����ϳɡ�Ӧ���Լ��Ի�����Ӱ��һֱ�ǿ�ѧ���о����ȵ㡣
(1)������Ҫ��NH3��CO2Ϊԭ�Ͻ��кϳɡ���Ҫͨ������������Ӧ����:
��Ӧ1��2NH3(l)+CO2(g)![]() H2NCOONH4(l)����H1= -117.2 kJ��mol-1
H2NCOONH4(l)����H1= -117.2 kJ��mol-1
��Ӧ2��H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l)����H2=+21.7 kJ��mol-1
H2O(l)+CO(NH2)2(l)����H2=+21.7 kJ��mol-1
��ش�CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ��H3=_____________���÷�Ӧ���Է����е���Ҫԭ����__________________��
2NH3(l)+CO2(g) ��H3=_____________���÷�Ӧ���Է����е���Ҫԭ����__________________��
(2)��̿����ԭSO2����S2����ѧ����ʽΪ��2C(s)+2SO2(g)![]() S2(g)+2CO2(g)���ں��������У�1 mol/LSO2�������Ľ�̿��Ӧ��SO2��ת�������¶ȵı仯��ͼ��ʾ��
S2(g)+2CO2(g)���ں��������У�1 mol/LSO2�������Ľ�̿��Ӧ��SO2��ת�������¶ȵı仯��ͼ��ʾ��
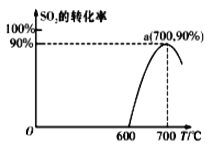
����700�������÷�Ӧ����3���Ӵﵽƽ�⣬����0��3����v(S2)=_______molL-1min-1�����¶��µ�ƽ�ⳣ��Ϊ_________��
�����÷�Ӧ����ʼ�¶�Ϊ700���ĺ��ݾ��������н��У��ﵽƽ��ʱSO2��ת����________90%(��������������������=��)��
������˵��һ����˵���÷�Ӧ�ﵽƽ��״̬����_______��
A����̿���������ٱ仯ʱ
B��CO2��SO2��Ũ�����ʱ
C��SO2������������CO2����������֮��Ϊ1:1
D����������ѹǿ���ٱ仯ʱ
(3) NO2��O2������KNO3������ȼ�ϵ�أ���ԭ����ͼ��ʾ��

ʯīI���������ķ�ӦΪ__________________________________�������·ͨ��1mole-�������Ϲ�����_______mol N2O5 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں���������ʵ���Һ�У������ж����ѧƽ��档
��1��һ���¶��£���1L0.1molL��1CH3COOH��Һ�м���0.1molCH3COONa���壬ƽ�������Һ��![]() ___�����������С�����䡱����д����ʾ�û����Һ����������Ũ�ȼ��һ����ʽ��______
___�����������С�����䡱����д����ʾ�û����Һ����������Ũ�ȼ��һ����ʽ��______
��2����������20mL 0.1molL��1Na2CO3��Һ����μ���0.1molL��1HCl��Һ40mL����Һ�к�̼Ԫ�صĸ�������CO2���ݳ�δ���������ʵ�����������ҺpH�仯��������£�
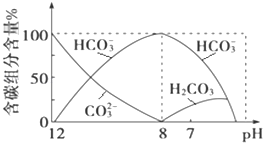
�ش��������⣺
����ͬһ��Һ�У�H2CO3��HCO3����CO32��___����ܡ����ܡ����������棻
�ڵ�pH��7ʱ����Һ�к�̼Ԫ�ص���Ҫ����_____��___����Һ�к������������������ʵ���Ũ�ȵĴ�С��ϵΪ____��
����֪��25��ʱ��CO32��ˮ�ⷴӦ��ƽ�ⳣ����ˮ�ⳣ��Kh�T2��10��4 molL��1������Һ��c��HCO3������c��CO32������2��1ʱ����Һ��pH��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NiCl2�ǻ����ϳ�������Ҫ����Դ����ҵ�����ú���(Ni)�ϴ�������Ҫ����Ni��������SiO2��Al2O3��Fe�������������ᡢ������ʣ������Ȼ������壨NiCl2��nH2O��������ͼ��
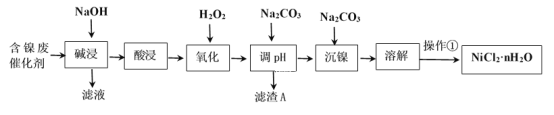
���ֽ�����������Ksp����ֵ���±���ʾ��
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp����ֵ | 10-17 | 10-38 | 10-34 | 10-15 |
�ش��������⣺
��1��Al��ԭ�ӽṹʾ��ͼΪ___��
��2��������������ܽ�����ʹ�õ���Ϊ___���������ʱ������Ӧ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O��____��
��3��������������H2O2��Һ����������___(�����ӷ���ʽ��ʾ)��Ȼ�����pHʹ��Һ����Ԫ��ǡ����ȫ����������Ũ����10-5mol��L-1ʱ�����ӳ�����ȫ������ʱ�����µ�pHԼΪ____��
��4��������������ʵ���������Ϊ�������ȣ�Ũ����___Ϊֹ����ȴ�ᾧ�����ˡ�ϴ�ӡ�������ò�Ʒ��
��5���������ѳ�Ϊ��϶�����������Ҫ������ͣ����ڼ��Ե������Һ�Ĺ���ԭ�����£�M+Ni(OH)2![]() MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��
MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵������ȷ����
A.��28g��ϩ�����У�һ����ƽ���ԭ����ĿΪ6NA
B.1mol��������(P4)�����������Ĺ��ۼ�����Ϊ4NA
C.25��ʱ��1LpH��1��H2SO4��Һ�к��е�H����Ϊ0.2NA
D.��״���£�22.4L��������������������Һ��Ӧ��ת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
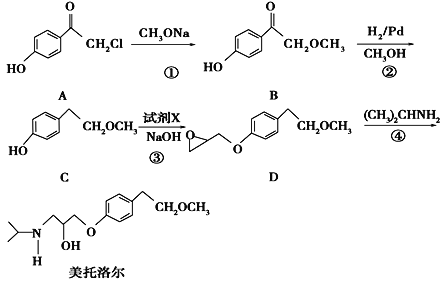
����Ŀ�����������һ�����Ƹ�Ѫѹ��ҩ����м��壬����ͨ�����·����ϳɣ�
��ش��������⣺
��1��д��C�еĹ����ŵ�����Ϊ_________________.
��2����������ķ���ʽ________________.
��3��д����Ӧ�ٵĻ�ѧ����ʽ__________________________________________����Ӧ�ڵķ�Ӧ������_____________
��4����Ӧ���м�����Լ�X�ķ���ʽΪC3H5OCl��X�Ľṹ��ʽΪ____________________.
��5����������������B��ͬ���칹������_______�֣����к˴Ź������������ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ3��2��2��1��1��1����________________________(д�ṹ��ʽ)
���ܷ���������Ӧ�����ܷ���ˮ��
������FeCl3��Һ������ɫ��Ӧ
��ֻ��һ����
��6����������֪ʶ�������Ŀ���������Ϣ��д����![]() ��
��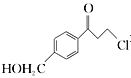 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ(���Լ���ѡ)���ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ(���Լ���ѡ)���ϳ�·������ͼʾ�����£�![]() _______________________
_______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ﶬ���������߷��ļ��ڣ���������β����ȼúβ���������������Ҫԭ��֮һ��
��1����ҵ�����ü������ԭNO���ɼ��ٵ���������ŷš�
��֪��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)��H=-574kJ��mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)��H=-1160kJ��mol1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ_____________________________________��
��2������β���������ǿ�������β���ŷš���������β����Ⱦ������Ч���ֶΣ���Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��H<0
N2(g)+2CO2(g)��H<0
T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ����(0��15min)��NO�����ʵ�����ʱ��仯����ͼ��ʾ��
����֪��ƽ��ʱ����ķ�ѹ������������������ϵ����ѹǿ��T��ʱ�ﵽƽ�⣬��ʱ��ϵ����ѹǿΪp=20MPa����T��ʱ�÷�Ӧ��ѹ��ƽ�ⳣ��Kp��_______��ƽ����������¶Ȳ��䣬���������г���NO��CO2��0.3mol��ƽ�⽫_____(����������ҡ�����)�ƶ���
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı������������__(�����)
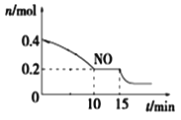
A.����COŨ��B.����C.��С�������D.�������
��3����ҵ�ϳ�����������Һ�������ķ�����ͬʱ����SO2���͵�������������(NOx)����������������Һ���տɵõ�Na2SO3��NaHSO3��NaNO2��NaNO3����Һ����֪�������£�HNO2�ĵ��볣��ΪKa=7��10-4��H2SO3�ĵ��볣��ΪKa1=1.2��10-2��Ka2=5.8��10-8��
�ٳ����£���ͬŨ�ȵ�Na2SO3��NaNO2��Һ��pH�ϴ����______��Һ��
�ڳ����£�NaHSO3��___��(�������������������������жϵ�������(ͨ������˵��)_____________��
��4����Ԫ��(Ce)����ϵ��������Ȼ�����ߵ�һ�֣�������+3��+4���ּ�̬�������к��д�������Ⱦ��NO�����Ա���Ce4+����Һ���գ�����NO2-��NO3-���������ʵ���֮��Ϊ1��1)���ɲ��õ�ⷨ����������Һ�е�NO2-ת��Ϊ�����ʣ�ͬʱ����Ce4+����ԭ����ͼ��ʾ��
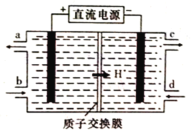
��Ce4+�ӵ��۵�_____(����ĸ����)��������
��д�������ĵ缫��Ӧʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����ļ���ȼ�ղ���ΪCO��CO2��ˮ�������˻��������49.6g�����仺��ͨ����ˮCaCl2ʱ��CaCl2����25.2g����ԭ���������CO������Ϊ�� ��
A.11.2gB.13.2gC.19.7gD.24.4g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com