
【题目】秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ΔH<0
N2(g)+2CO2(g)ΔH<0
T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__(填序号)
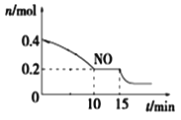
A.增大CO浓度B.升温C.减小容器体积D.加入催化剂
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下,NaHSO3显___性(填“酸”“碱”或“中”,判断的理由是(通过计算说明)_____________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
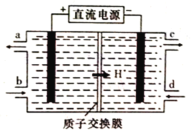
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:_______________________________。
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol1 0.0875(MPa)-1或![]() (MPa)-1 不 AC Na2SO3 酸 因为HSO3-的电离常数Ka2=5.8×10-8,水解常数Kh=
(MPa)-1 不 AC Na2SO3 酸 因为HSO3-的电离常数Ka2=5.8×10-8,水解常数Kh=![]() ≈8.3×10-13,电离常数大于水解常数,所以溶液显酸性 a 2NO2-+8H++6e=N2↑+4H2O
≈8.3×10-13,电离常数大于水解常数,所以溶液显酸性 a 2NO2-+8H++6e=N2↑+4H2O
【解析】
(4)电解过程中Ce3+在阳极失电子,变为Ce4+,则b进Ce3+,a出Ce4+,NO2-在阴极得电子变为N2,则d进NO2-,c出N2。
(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ·mol1
![]() 得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=
得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=![]() =-867kJ·mol1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol1;
=-867kJ·mol1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol1;
(2)①由图可知,NO起始物质的量为0.4mol,0到15min共减少了0.2mol,则 ,平衡时p(NO)= 20MPa×
,平衡时p(NO)= 20MPa×![]() =
=![]() MPa,同理可得:p(CO)=
MPa,同理可得:p(CO)=![]() MPa,p(N2)=
MPa,p(N2)=![]() MPa,p(CO2) =
MPa,p(CO2) =![]() MPa,所以Kp=
MPa,所以Kp=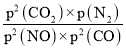 =
=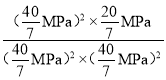 =0.0875(MPa)-1或
=0.0875(MPa)-1或![]() (MPa)-1。再向容器中充入NO和CO2各0.3mol,加入的NO和CO2物质的量相等,那么二者引起压强增大量相等,假设二者引起的压强增量分别为p,则Qc=
(MPa)-1。再向容器中充入NO和CO2各0.3mol,加入的NO和CO2物质的量相等,那么二者引起压强增大量相等,假设二者引起的压强增量分别为p,则Qc=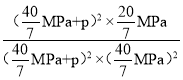 =
=![]() (MPa)-1,Qc=Kp,平衡不移动,故答案为:0.0875(MPa)-1或
(MPa)-1,Qc=Kp,平衡不移动,故答案为:0.0875(MPa)-1或![]() (MPa)-1;不;
(MPa)-1;不;
②由图可知NO物质的量减小,说明平衡正向移动。
A.增大CO浓度,平衡正向移动,NO物质的量减小,A正确;
B.升温,平衡逆向移动,NO物质的量增大,B错误;
C.减小容器体积,等同于增大压强,平衡正向移动,NO物质的量减小,C正确;
D.加入催化剂,反应速率增大,但平衡不移动,NO物质的量不变,D错误;
故答案为:AC;
(3)①HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8可知,HNO2的酸性强于HSO3-的酸性,则NO2-的水解程度小于SO32-,所以相同浓度的Na2SO3、NaNO2溶液,Na2SO3的碱性更强,pH更大,故答案为:Na2SO3;
②HSO3-+H2O![]() H2SO3,Ka2×Kh=Kw,故HSO3-的水解常数Kh=
H2SO3,Ka2×Kh=Kw,故HSO3-的水解常数Kh=![]() ≈8.3×10-13,又因为HSO3-的电离常数Ka2=5.8×10-8,所以,HSO3-的电离常数大于水解常数,常温下,NaHSO3显酸性,故答案为:酸;因为HSO3-的电离常数Ka2=5.8×10-8,水解常数Kh=
≈8.3×10-13,又因为HSO3-的电离常数Ka2=5.8×10-8,所以,HSO3-的电离常数大于水解常数,常温下,NaHSO3显酸性,故答案为:酸;因为HSO3-的电离常数Ka2=5.8×10-8,水解常数Kh=![]() ≈8.3×10-13,电离常数大于水解常数,所以溶液显酸性;
≈8.3×10-13,电离常数大于水解常数,所以溶液显酸性;
(4)①生成Ce4+,则Ce3+-e-= Ce4+,Ce4+在阳极生成,从a口流出,故答案为:a;
②NO2-转化为无毒物质,则NO2-在阴极得电子,转化为N2,结合电子得失守恒、电荷守恒可得阴极电极反应为:2NO2-+8H++6e=N2↑+4H2O,故答案为:2NO2-+8H++6e=N2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )
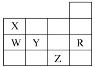
A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素的第一电离能:Al____Si(填“>”或“<”),按电负性由大到小的顺序排列N、O、F___。
(2)基态Mn2+的核外电子排布式为___。
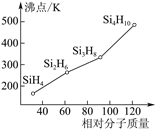
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是___。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
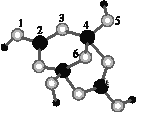
①在Xm-中,硼原子轨道的杂化类型有___;配位键存在于___原子之间(填原子的数字标号)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有___(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力E.氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技创新的产品设备在工作时有化学能转变成电能的是( )
A. [Failed to download image : http://192.168.0.10:8086/QBM/2019/6/24/2232583815659520/2233878409273344/STEM/470d05a5dd2448b794aa06c917ec6f19.png]长征5号火箭使用的液氧煤油发动机
B.  北斗导航卫星的太阳能电池板
北斗导航卫星的太阳能电池板
C.  位于江苏的海上风力发电厂
位于江苏的海上风力发电厂
D.  世界首部可折叠柔屏手机
世界首部可折叠柔屏手机
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
Ⅰ.A是石油裂解气的主要成分,A的产量通常是衡量一个国家石油化工水平的标准。
Ⅱ.2CH3CHO+O2→2CH3COOH。
现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
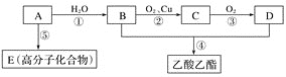
请回答下列问题。
(1)写出A的结构简式:___。
(2)B物质的名称是___。
(3)E___(填“能或不能”)使酸性高锰酸钾溶液褪色
(4)写出下列反应方程式及反应类型:
②化学方程式__,反应类型___。
④化学方程式__,反应类型___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.NH4Cl固体与固体烧碱混合共热:![]() +OH-
+OH- ![]() NH3↑+H2O
NH3↑+H2O
B.铜和稀硝酸的反应:Cu+4H++NO![]() =Cu2++NO↑+2H2O
=Cu2++NO↑+2H2O
C.Ba(OH)2和(NH4)2SO4溶液的混合加热:Ba2++2OH-+2![]() +
+![]()
![]() BaSO4↓+2NH3↑+2H2O
BaSO4↓+2NH3↑+2H2O
D.向氯化铁溶液中加入稀氨水:Fe3++3OH-=Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)除去B中混有的少量杂质A,所用的试剂为______________。
(4)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①乙酸 ②苯酚 ③碳酸 ④乙醇
I.甲同学设计并实施了如下实验方案。
编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①③溶液 | 略 |
2 | 将CO2通入C6H5ONa溶液中 | 方程式:______________。 | |
3 | 配制等物质的量浓度的CH3COONa、 NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于 CH3COONa溶液 | 略 |
4 | 向含酚酞的NaOH溶液中,各滴加等量的②④两种溶液 | ④中无明显现象 ②中红色明显变浅 | 滴加②时方程式:______。 |
结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)______________。 | |||
II.乙同学对甲同学的实验提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)D中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列
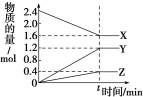
表述中正确的是
A.反应的化学方程式为2X = 3Y + Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com