
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)除去B中混有的少量杂质A,所用的试剂为______________。
(4)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_______。
【答案】乙醇 CH2=CH2+HCl![]() CH3CH2Cl 加成反应
CH3CH2Cl 加成反应 ![]() 加聚反应 溴水 ② 乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷、二氯乙烷、三氯乙烷等多种取代产物,产物不唯一,而乙烯和氯化氢能发生加成反应得到氯乙烷,产物只有一种
加聚反应 溴水 ② 乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷、二氯乙烷、三氯乙烷等多种取代产物,产物不唯一,而乙烯和氯化氢能发生加成反应得到氯乙烷,产物只有一种
【解析】
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯;在催化剂条件下,A反应生成高分子化合物E,则E是聚乙烯,乙烯和氯化氢发生加成反应生成C,C为氯乙烷;乙烯和氢气发生加成反应生成B,B为乙烷,B和氯气发生取代反应生成C(氯乙烷),反应①②③属于同种反应类型,则A和水发生加成反应生成D,D为乙醇,据此分析解答。
(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,结合上述分析,D为乙醇,故答案为:乙醇;
(2)反应②为一定条件下,乙烯和氯化氢发生加成反应生成氯乙烷,反应方程式为CH2=CH2+HCl![]() CH3CH2Cl,该反应属于加成反应;反应④为加热、催化剂条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为
CH3CH2Cl,该反应属于加成反应;反应④为加热、催化剂条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为![]() ,该反应属于加聚反应,故答案为:CH2=CH2+HCl
,该反应属于加聚反应,故答案为:CH2=CH2+HCl![]() CH3CH2Cl;加成反应;
CH3CH2Cl;加成反应;![]() ;加聚反应;
;加聚反应;
(3)除去乙烷中混有的少量乙烯,可以将混合气体通入溴水中洗气,故答案为:溴水;
(4)乙烷为饱和烃,与氯气在光照条件下发生取代反应,得到的产物除了氯乙烷外,还有: 1,1-二氯乙烷,1,2-二氯乙烷,1,1,2-三氯乙烷,1,1,2,2-四氯乙烷,1,1,1,2-四氯乙烷,1,1,1,2,2-五氯乙烷,六氯乙烷和氯化氢,产物不唯一;乙烯与HCl在催化作用下可发生加成反应,方程式为CH2=CH2+HCl![]() CH3CH2Cl,产物只有一种,因此制备氯乙烷的最好途径是反应②,故答案为:②;乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷、二氯乙烷、三氯乙烷等多种取代产物,产物不唯一,而乙烯和氯化氢能发生加成反应得到氯乙烷,产物只有一种。
CH3CH2Cl,产物只有一种,因此制备氯乙烷的最好途径是反应②,故答案为:②;乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷、二氯乙烷、三氯乙烷等多种取代产物,产物不唯一,而乙烯和氯化氢能发生加成反应得到氯乙烷,产物只有一种。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
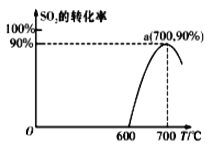
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成:
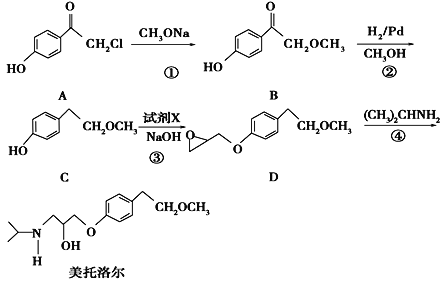
请回答下列问题:
(1)写出C中的官能团的名称为_________________.
(2)美托洛尔的分子式________________.
(3)写出反应①的化学方程式__________________________________________;反应②的反应类型是_____________
(4)反应③中加入的试剂X的分子式为C3H5OCl,X的结构简式为____________________.
(5)满足下列条件的B的同分异构体有有_______种,其中核磁共振氢谱有六种不同化学环境的氢,且峰面积比为3∶2∶2∶1∶1∶1的是________________________(写结构简式)
①能发生银镜反应而且能发生水解
②能与FeCl3溶液发生显色反应
③只有一个甲基
(6)根据已有知识并结合题目所给相关信息,写出以![]() 和
和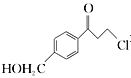 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:![]() _______________________
_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ΔH<0
N2(g)+2CO2(g)ΔH<0
T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__(填序号)
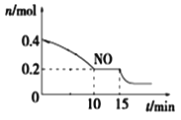
A.增大CO浓度B.升温C.减小容器体积D.加入催化剂
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下,NaHSO3显___性(填“酸”“碱”或“中”,判断的理由是(通过计算说明)_____________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
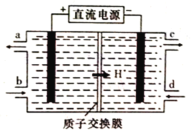
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.68LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗溶液NaOH的体积是( )
A.60mLB.45mLC.30mLD.15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
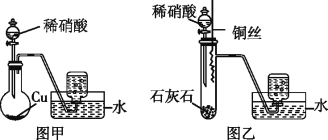
【题目】某研究性学习小组的同学为了制取NO并探究其性质,进行了如下实验。
试回答下列问题:
(1)某同学用图甲装置进行实验,收集到无色气体,由此确定铜和稀硝酸反应生成NO气体。该同学的推断不合理的理由是__________ (用化学方程式表示)。
(2)另一名同学设计了图乙装置进行实验,步骤如下:①在大试管中放入适量石灰石,加入过量稀硝酸;②待石灰石反应完全,将铜丝浸入过量的稀硝酸中;③一段时间后,观察到大试管中气体始终为无色,收集反应产生的气体。其中步骤①的作用是___________。
(3)当过量的铜与稀硝酸完全反应后,再加20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是___(填选项编号),反应的离子方程式为__________。
a.还原剂 b.氧化剂 c.提供氢离子 d.提供热能
(4)某些资料认为NO不能与Na2O2反应。有同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。
查阅资料:a.2NO+Na2O2=2NaNO2
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O
c.酸性条件下,NO能被MnO![]() 氧化成NO
氧化成NO![]()
该同学利用图中装置来探究NO与Na2O2的反应(装置可重复使用)。
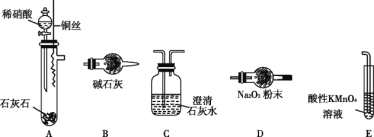
①装置的连接顺序为A→_________,装置E的作用是 __________。
②充分反应后,欲检验装置D中是否生成了NaNO2,请简述实验方案_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂严重影响人体徤康,化合物H是一种临床治疗高血脂症的药物。H的结构简式如图所示。
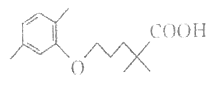
下列说法不正确的是( )
A. 有机物H含有的官能团只有羧基
B. 1mol H完全燃烧消耗19molO2
C. 有机物H是芳香化合物
D. 有机物H能和钠、碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的甲烷燃烧产物为CO、CO2和水蒸气,此混合气体重49.6g,当其缓慢通过无水CaCl2时,CaCl2增重25.2g,则原混合气体中CO的质量为( )
A.11.2gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)( )
A. 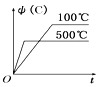 B.
B. 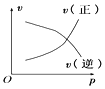
C. 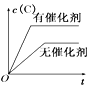 D.
D. 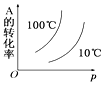
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com