
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
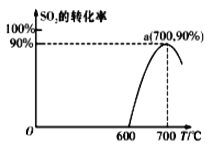
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
【答案】+95.5 kJ·mol-1 ΔS>0 0.15 36.45 < AD NO2+NO3--e-=N2O5 0.5
【解析】
(1)根据盖斯定律(反应1+反应2)×(-1)得到;反应自发进行的条件是△H-T△S<0;
(2)①利用反应的三段式结合反应速率公式、平衡常数表达式计算;
②700℃时升高温度,SO2的转化率降低,则平衡逆向移动,正向反应为放热反应,该体系相当在恒温恒容平衡体系中升温,平衡逆向移动;
③化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(3)石墨I为电池的负极:NO2失电子生成N2O5,写出电极反应式;写出反应的总方程式再计算电子转移数。
(1)反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
根据盖斯定律(反应1+反应2)×(-1)得到:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=[-117.2 kJ·mol-1+(+21.7 kJ·mol-1)]×(-1)=+95.5 kJ·mol-1 ,该反应能自发进行的主要原因是:该反应是吸热反应,反应能发生则△S>0;
2NH3(l)+CO2(g) ΔH3=[-117.2 kJ·mol-1+(+21.7 kJ·mol-1)]×(-1)=+95.5 kJ·mol-1 ,该反应能自发进行的主要原因是:该反应是吸热反应,反应能发生则△S>0;
(2)① 反应的三段式为 2C(s)+2SO2(g)![]() S2(g)+2CO2(g)
S2(g)+2CO2(g)
起始浓度(mol·L-1) 1 0 0
变化浓度(mol·L-1) 0.9 0.45 0.9
平衡浓度(mol·L-1) 0.1 0.45 0.9
v(S2)=△c÷△t=0.45mol·L-1÷3min=0.15mol/(L·min)
该温度下的平衡常数k=![]() =
=![]() =36.45;
=36.45;
②1 mol·L-1SO2与足量的焦炭在恒容、700℃反应时,SO2的转化率为90%,若1 mol·L-1SO2与足量的焦炭在恒容、绝热容器中反应,由于反应放热,容器内温度升高,所以恒容、绝热容器中的反应相当在恒容、700℃反应平衡的基础上升温,则平衡逆向进行,SO2的转化率降低;
③A.焦炭的质量减少,则反应正向进行,焦炭的质量增加,则反应逆向进行,若焦炭的质量不再变化时,则反应达到平衡状态,故A正确;
B.CO2、SO2的浓度相等时,不能确定正逆反应速率是否相等,所以不能确定反应是否达到平衡状态,故B错误;
C.无论反应是否达到平衡,SO2的消耗速率与CO2的生成速率始终相等,所以SO2的消耗速率与CO2的生成速率之比为1:1时,不能确定反应状态是否平衡,故C错误;
D.反应正向是气体体积增大的反应,反应正向进行,容器压强增大,逆向进行,容器压强减小,所以容器的总压强不再变化时,反应达到平衡状态,故D正确;
故选AD;
(3)石墨I,NO2失电子生成N2O5,附近发生的反应为NO2+NO3--e-=N2O5;
总反应为:4NO2+O2=2N2O5,每转移4mol电子,生成2molN2O5,当外电路通过1mole-,正极上共消耗 0.5mol N2O5 。


科目:高中化学 来源: 题型:
【题目】乙醇分子中化学键如图: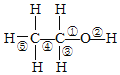
⑴与金属钠反应时,键_________断裂;
⑵与浓硫酸共热制乙烯时,键________断裂;
⑶催化氧化为醛时,键______断裂,
⑷与乙酸、浓硫酸混合制乙酸乙酯,键_____断裂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烷烃分子中含共价键的数目为16,则该烷烃的分子式为____________,其一氯代物只有一种的烷烃的结构简式为_____________。
(2)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
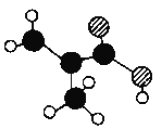
①该物质的结构简式为________________。
②下列物质中,与该物质互为同系物的是(填序号)__________,互为同分异构体的是________。
A.CH3CH=CHCOOH B.CH2=CHCOOCH3
C.CH3CH2CH=CHCOOH D.CH3CH(CH3)COOH
(3)药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。
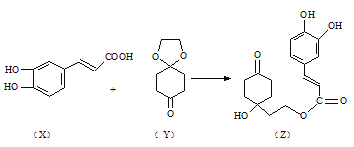
试填空:
① X的分子式为_____________ ;该分子中最多共面的碳原子数为___________ 。
②Y中是否含有手性碳原子______________(填“是”或“否”)。
③1molZ与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠______________mol;1molZ与足量的浓溴水充分反应,需要消耗Br2_____________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )
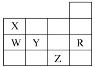
A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A. 0.10mol/LAg+B. 0.20mol/LZn2+C. 0.20mol/LCu2+D. 0.20mol/LPb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)乙醇分子中C原子的杂化方式是_________
(4)[Cu(NH3)4]2+中,提供孤对电子的是________,Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是_______(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是_________。
(5)硫元素对应的含氧酸酸性是H2SO4
强于H2SO3,其原因为___________________。
(6)铜的一种氧化物晶体结构如图所示,
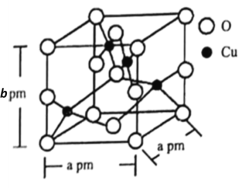
该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kb、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是______。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=____。
(3)高炉炼铁中发生的反应有FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是______(已知lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素的第一电离能:Al____Si(填“>”或“<”),按电负性由大到小的顺序排列N、O、F___。
(2)基态Mn2+的核外电子排布式为___。
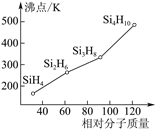
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是___。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
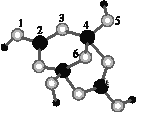
①在Xm-中,硼原子轨道的杂化类型有___;配位键存在于___原子之间(填原子的数字标号)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有___(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力E.氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)除去B中混有的少量杂质A,所用的试剂为______________。
(4)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com