
已知可逆反应:X(s)+aY(g) bZ(g);ΔH,反应达到平衡时,温度、压强对可逆反应的影响如右图所示(图中p为压强,其中p1>p2)。下列有关判断正确的是( )
bZ(g);ΔH,反应达到平衡时,温度、压强对可逆反应的影响如右图所示(图中p为压强,其中p1>p2)。下列有关判断正确的是( )
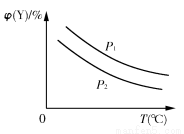
A.可逆反应的焓变ΔH<0
B.反应的化学计量数a<b
C.该可逆反应的平衡常数K=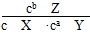
D.温度、压强不变,若使用合适的催化剂,可以提高Y的转化率
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可依次通过下列哪组试剂的洗气瓶( )
A.澄清石灰水、浓H2SO4
B.溴水、浓H2SO4
C.酸性高锰酸钾溶液、浓H2SO4
D.浓H2SO4、酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入NH4Cl固体 ⑤向水中加入NaHCO3固体 ⑥向水中加入NaHSO4固体
A.①②⑤ B.①④ C.③④⑥ D.④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A.AlCl3溶液中再溶入AlCl3
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.醋酸溶液加热
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
在一密闭恒容的容器中,可逆反应3A(g) 3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
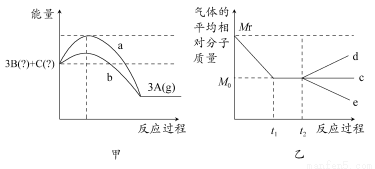
(1)由图甲可以判断3A(g) 3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
(2)由图乙可以得出有关B和C状态的结论是________。
①若t2时刻升高温度,气体的平均相对分子质量变化一定符合________线(填“c”“d”或“e”)。
②若改变压强,气体的平均相对分子质量变化一定符合c线,则C物质的状态为________。
(3)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是________状态,C是________状态。
(4)如果B为气体,C为固体,取0.3 mol A恒温下在1 L容器中充分反应,平衡时测得B的浓度为0.21 mol/L。若使反应从逆反应开始,起始时在容器中加入0.3 mol B,同样条件下,要使平衡时B的浓度仍为0.21 mol/L,则C的物质的量的取值范围应该是________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
当把晶体N2O4放入恒容的密闭容器中,待全部气化并建立N2O4 2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是( )
2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是( )
A.c(NO2) B.c(N2O4) C. 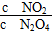 D.
D. 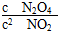
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:填空题
在一个体积为1 L的密闭容器中发生某化学反应:2A(g) B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
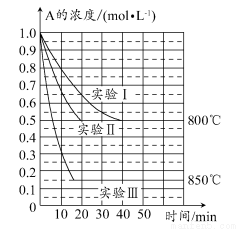
试回答下列问题:
(1)在实验Ⅰ中,反应在20~40 min内A的平均反应速率为________mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是________________。
(2)该反应的ΔH________0,其判断理由是________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L-1 B.0.4 mol·L-1 C.0.7 mol·L-1 D.0.8 mol·L-1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应________。
A.等于86% B.等于50%
C.小于50% D.介于50%~86%之间
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:填空题
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
物质的量/ mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图:
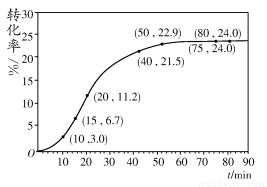
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
反应时间 范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
平均反应速率 /(10-3 mol·min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
请计算15~20 min范围内甲酸甲酯的减少量为________ mol,甲酸甲酯的平均反应速率为________ mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
____________________________________________________________
(3)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。

查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S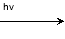 TiO2/S*(激发态)
TiO2/S*(激发态)
TiO2/S*―→TiO2/S++e-
I3—+2e-―→3I-
2TiO2/S++3I-―→2TiO2/S+I3—
下列关于该电池叙述错误的是( )
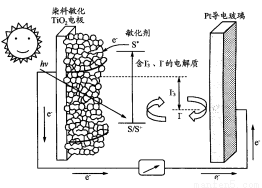
A.电池工作时,I-在镀铂导电玻璃电极上放电
B.电池工作时,是将太阳能转化为电能
C.电池的电解质溶液中I-和I3—的浓度不会减少
D.电池中镀铂导电玻璃为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com