
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如图所示。

(1)A的结构简式为__________,B分子中的官能团名称为__________。
(2)反应⑦中物质X的分子式为__________,反应⑦的反应类型是____________。
(3)反应⑤的化学方程式为________________________________________。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是______________________________。
(4)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为______________________________。
(5)取少量反应①后的溶液于试管中,证明反应①是否发生,需要的试剂有_____________。
A.NaOH溶液 B.稀硫酸 C.银氨溶液 D.碘水
(6)写出满足以下条件的C的所有同分异构体:能够与NaHCO3反应。________________________________
【答案】 CH3CHO 羧基 Br2 加成反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O NaOH溶液 C4H6O4 AC CH3CH2CH2COOH , CH3(CH3)CHCOOH
CH3COOCH2CH3+H2O NaOH溶液 C4H6O4 AC CH3CH2CH2COOH , CH3(CH3)CHCOOH
【解析】(1)乙醇能在铜作催化剂的条件下与氧气发生催化氧化反应生成乙醛,则A为乙醛,答案为CH3CHO;乙醛能与氧气在催化剂的条件下发生反应生成乙酸,则B为乙酸,答案为:羧基。
(2)反应⑦是乙烯与溴发生加成反应生成1,2-二溴乙烷,所以反应⑦中物质X的分子式为Br2;答案为Br2;加成反应;
(3)反应⑤是乙酸与乙醇发生酯化反应生成乙酸乙酯,答案为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;乙烯与NaOH溶液不反应,而SO2能与NaOH溶液反应生成亚硫酸钠,所以除去乙烯中混有的SO2气体选用的试剂是NaOH溶液;答案为NaOH溶液;
CH3COOCH2CH3+H2O;乙烯与NaOH溶液不反应,而SO2能与NaOH溶液反应生成亚硫酸钠,所以除去乙烯中混有的SO2气体选用的试剂是NaOH溶液;答案为NaOH溶液;
(4)已知D的相对分子量为118,碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则分子中含有的碳原子数为118×40.68%÷12=4,含氢原子数为118×5.08%÷1=6,含氧原子数为118×(1-40.68%-5.08%)÷16=4,所以D的分子式为C4H6O4 ;答案为C4H6O4 ;
(5)反应①是淀粉在稀硫酸催化下发生水解反应生成葡萄糖,若水解反应发生,则会产生葡萄糖,葡萄糖是五羟基醛,只要检验醛基是否存在即可,实验方案为:取反应①的溶液2mL于试管中,用10%的NaOH溶液调节溶液至中性,再向其中加入2mL10%的NaOH溶液,再加入4~5滴5%的CuSO4溶液,加热一段时间。若有砖红色沉淀,则证明反应①已发生;答案选AC。
(6)分子式为C4H8O2,能够与NaHCO3反应的有机物含有羧基,这样的结构有2种:. CH3CH2CH2COOH 、 CH3(CH3)CHCOOH;答案为CH3CH2CH2COOH 、CH3(CH3)CHCOOH;


科目:高中化学 来源: 题型:
【题目】实验需要![]() NaOH溶液475mL和
NaOH溶液475mL和![]() 硫酸溶液
硫酸溶液![]() 根据这两种溶液的配制情况回答下列问题:
根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______![]() 填序号
填序号![]() ,配制上述溶液还需用到的玻璃仪器是______
,配制上述溶液还需用到的玻璃仪器是______![]() 填仪器名称
填仪器名称![]() .
.

(2)下列操作中,不能用容量瓶实现的有______![]() 填序号
填序号![]() .
.
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______![]() 在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______
在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______![]() 填”大于”、“等于”或“小于”,下同
填”大于”、“等于”或“小于”,下同![]() 若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______
若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______![]() .
.
(4)根据计算得知,所需质量分数为![]() 、密度为
、密度为![]() 的浓硫酸的体积为______
的浓硫酸的体积为______![]() 计算结果保留一位小数
计算结果保留一位小数![]() 如果实验室有10mL、15mL、20mL、50mL量筒,选用______mL量筒最好.
如果实验室有10mL、15mL、20mL、50mL量筒,选用______mL量筒最好.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:S(g) + O2 (g) = SO2(g) ΔH=-Q1kJ/mol ; S(s) + O2 (g) = SO2(g) ΔH=-Q2 kJ/mol。 则Q1 Q2
A. 大于 B. 小于 C. 等于 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研与生活中有很重要的作用。回答下列问题:
(1)碘可用作心脏起搏器电源——锂碘电池的材料,则碘电极是电池的______(填“正”或“负”)极。
(2)“加碘食盐”中含有少量的KIO3,向其中加入亚硫酸氢钠溶液,能产生使淀粉变蓝的物质,则该反应中氧化剂与还原剂的物质的量之比是_______________。
(3)碘单质与氢气反应的能量变化过程如图所示:

写出碘I2(s)转化成碘I2(g)的热化学方程式:__________________________________。
(4)在合成氨工业中用I2O5来测定CO的含量:5CO(g)+I2O5(s) ![]() 5CO2(g)+I2(s),在装有足量的I2O5固体的2L恒容密闭容器中通入2molCO发生上述反应,测得温度T1、T2下,一氧化碳的体积分数
5CO2(g)+I2(s),在装有足量的I2O5固体的2L恒容密闭容器中通入2molCO发生上述反应,测得温度T1、T2下,一氧化碳的体积分数![]() (CO)随时间t的变化曲线如图所示。回答下列问题:
(CO)随时间t的变化曲线如图所示。回答下列问题:
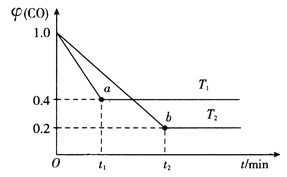
①温度T1下的平衡转化率![]() =________%,b点的平衡常数K2=__________。
=________%,b点的平衡常数K2=__________。
②在温度T2下,反应达到平衡后再充入适量的CO,重新达到平衡时;CO气体的转化率将_______(填“变大”“变小”或“不变”),该反应的△H_____(填“>”“<"或“=”)0。
③下列各种措施能提高该反应的CO转化率的是____________。
A.升温 B.加压 C.添加催化剂 D.移走部分CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液、②含有泥沙的食盐水、③溶有碘(I2)的碘化钾溶液、④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。

请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )

A. ①﹣(3)﹣分液
B. ②﹣(2)﹣过滤
C. ③﹣(2)﹣萃取
D. ④﹣(1)﹣蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设一个蛋白质分子是由二条肽链共500个氨基酸分子组成,则此蛋白质分子中-COOH数目至少为( )
A. 2个 B. 501个 C. 502个 D. 1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是()
A. 在过滤、蒸发、溶解、蒸馏、萃取实验操作中一定要用到玻璃棒的是过滤、蒸发、溶解
B. 200ml 0.25mol/L HCl 溶液与 100ml 0.5mol/L NaCl 溶液所含的 Cl-的物质的量浓度相同
C. 将 5mol/L 的 Mg(NO3)2 溶液 a ml 稀释至 b ml,稀释后溶液中 NO3-的物质的量浓度变为10a/b mol/L
D. 某位同学配制一定物质的量浓度的 NaOH 溶液时,溶解后未冷却至室温就进行后续正常操作, 则造成所配溶液的浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提高能源的利用率已成为国际能源研究的热点课题.下列相关措施使用不当的是( )
A.使燃料充分燃烧
B.加大能源开采力度
C.加强能源利用的科技投入
D.合理使用能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com