
【题目】实验需要![]() NaOH溶液475mL和
NaOH溶液475mL和![]() 硫酸溶液
硫酸溶液![]() 根据这两种溶液的配制情况回答下列问题:
根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______![]() 填序号
填序号![]() ,配制上述溶液还需用到的玻璃仪器是______
,配制上述溶液还需用到的玻璃仪器是______![]() 填仪器名称
填仪器名称![]() .
.

(2)下列操作中,不能用容量瓶实现的有______![]() 填序号
填序号![]() .
.
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______![]() 在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______
在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______![]() 填”大于”、“等于”或“小于”,下同
填”大于”、“等于”或“小于”,下同![]() 若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______
若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______![]() .
.
(4)根据计算得知,所需质量分数为![]() 、密度为
、密度为![]() 的浓硫酸的体积为______
的浓硫酸的体积为______![]() 计算结果保留一位小数
计算结果保留一位小数![]() 如果实验室有10mL、15mL、20mL、50mL量筒,选用______mL量筒最好.
如果实验室有10mL、15mL、20mL、50mL量筒,选用______mL量筒最好.
【答案】AC烧杯、玻璃棒、500mL容量瓶BCEF![]() 大于等于
大于等于![]() 15
15
【解析】
(1)用容量瓶配制溶液,用胶头滴管定容,溶解或稀释时要用到烧杯,搅拌或引流用的玻璃棒,量筒可以用来量水,配制溶液肯定不需要的是圆底烧瓶和分液漏斗,故选AC. 配制上述溶液还需要的玻璃仪器有:玻璃棒、烧杯、500mL容量瓶。
(2)A.容量瓶用于配制一定体积物质的量浓度的溶液,所以A是正确的;B.容量瓶只能用来配制一定体积准确浓度的溶液,不能用于贮存溶液,故B错误;C.容量瓶不能配制或测量容量瓶规格以下的任意体积的液体,故C错误;D.容量瓶能准确稀释某一浓度的溶液,所以D选项是正确的;E.容量瓶只有一个刻度线,故不能量取一定体积的液体,故E错误;F.容量瓶不能受热,故不能用来加热溶解固体溶质,故F错误;所以选项是BCEF。
(3) 因为需要配制![]() NaOH溶液475mL,根据容量瓶的规格,需选择500mL容量瓶,,需要氢氧化钠的质量为m=0.5L
NaOH溶液475mL,根据容量瓶的规格,需选择500mL容量瓶,,需要氢氧化钠的质量为m=0.5L![]() 40g/mol=16.0g,所以用托盘天平称取NaOH的质量为16.0
40g/mol=16.0g,所以用托盘天平称取NaOH的质量为16.0![]() 在实验中其他操作均正确,若定容时俯视刻度线,溶液的体积减小,所以溶液浓度大于
在实验中其他操作均正确,若定容时俯视刻度线,溶液的体积减小,所以溶液浓度大于![]() 若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度等于
若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度等于![]()
(4)要配制 ![]() 硫酸溶液
硫酸溶液![]() ,需质量分数为
,需质量分数为![]() 、密度为
、密度为![]() 的浓硫酸的体积为
的浓硫酸的体积为![]() )/98g.mol-1,所以V=10.9m。如果实验室有10mL、15mL、20mL、50mL量筒,选用15mL 量筒最好。答案:
)/98g.mol-1,所以V=10.9m。如果实验室有10mL、15mL、20mL、50mL量筒,选用15mL 量筒最好。答案:![]() 、 15。
、 15。


科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
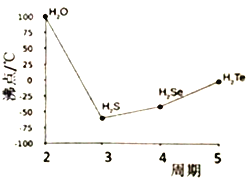
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
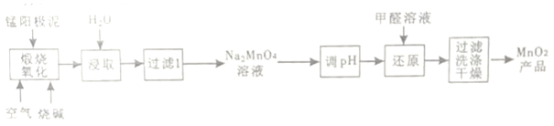
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯因研制合成氨作出重大贡献而获得1918年诺贝尔化学奖,如今可以用电化学的方法合成氨,装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( )
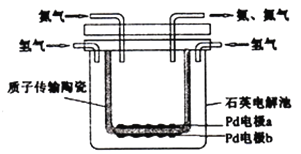
A. Pd电极b为阴极 B. 阴极的反应式为:N2+6H++6e-=2NH3
C. H+由阳极向阴极迁移 D. 陶瓷可以隔离N2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过用水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钾、氢氧化钠B.氧化铜、二氧化锰
C.氯化钾、二氧化锰D.硫酸铜、氢氧化钡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去甲烷中混有的乙烯,得到纯净的甲烷,最好依次通过( )
A.溴水,烧碱溶液,浓H2SO4
B.酸性KMnO4溶液,浓H2SO4
C.澄清石灰水,浓H2SO4
D.浓H2SO4 , 酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )

A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(4分)在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是 ,一定互为同分异构体的是 。(填编号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如图所示。

(1)A的结构简式为__________,B分子中的官能团名称为__________。
(2)反应⑦中物质X的分子式为__________,反应⑦的反应类型是____________。
(3)反应⑤的化学方程式为________________________________________。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是______________________________。
(4)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为______________________________。
(5)取少量反应①后的溶液于试管中,证明反应①是否发生,需要的试剂有_____________。
A.NaOH溶液 B.稀硫酸 C.银氨溶液 D.碘水
(6)写出满足以下条件的C的所有同分异构体:能够与NaHCO3反应。________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com