
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
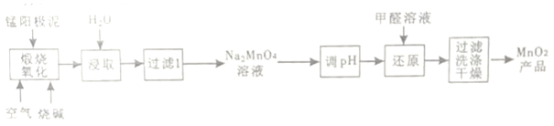
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
【答案】 4mol 2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O 煅烧后固体进行粉碎,适量增大水的量 适当提高浸取温度,充分搅拌 MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去
2Na2MnO4+2H2O 煅烧后固体进行粉碎,适量增大水的量 适当提高浸取温度,充分搅拌 MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去 ![]() ×100%
×100%
【解析】 (1)“煅烧氧化”时MnO![]() Na2MnO4锰由+2价变成+6价,失去电子为4e- ,1mol MnO煅烧完全失去电子的物质的量为4mol;MnO2煅烧反应的化学方程式为2MnO2+4NaOH+O2
Na2MnO4锰由+2价变成+6价,失去电子为4e- ,1mol MnO煅烧完全失去电子的物质的量为4mol;MnO2煅烧反应的化学方程式为2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O。
2Na2MnO4+2H2O。
(2)“浸取”时,为提高Na2MnO4的浸取率,就是增大化学反应速率,所以可采取的措施有:煅烧后固体进行粉碎,增大接触面积,适量增大水的量促进溶解,;适当提高浸取温度,加快化学反应速率,充分搅拌让物质充分迅速
(3)Na2MnO4中Mn的化合价为+6 ,MnO2中Mn的化合价为+4, Na2MnO4自身发生氧化还原反应,Mn的化合价为要升高,即发生MnO2 ![]() Na2MnO4
Na2MnO4 ![]() MnO4_,所以能生成MnO2,MnO4-(或NaMnO4)
MnO4_,所以能生成MnO2,MnO4-(或NaMnO4)
用pH试纸测定溶液pH的操作操作为(6). 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 。答案:MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 。
(4)由 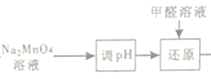 “还原指Na2MnO4与甲醛反应,发生反应的化学方程式为2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH。
“还原指Na2MnO4与甲醛反应,发生反应的化学方程式为2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH。
(5)达滴定终点时判断依据是:滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去。
由5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
5 2
X c2v2 X=![]() = 2.5C2V2
= 2.5C2V2
由Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4
1 1
C1V1-2.5C2V2 Y Y= (C1V1-2.5C2V2)mol
产品中MnO2的质量分数为m(MnO2)= (C1V1-2.5C2V2)mol![]() 87g/mol=87 (C1V1-2.5C2V2)/1000g
87g/mol=87 (C1V1-2.5C2V2)/1000g
产品中MnO2的质量分数为ω(MnO2)= 87(C1V1-2.5C2V2)/1000m![]() 100
100![]()


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中Al2(SO4)3与硫磺反应生成一种能使品红溶液褪色的物质和一种具有两性的物质,写出该反应化学方程式______________________________________________________。
(2)试剂X最好为下列试剂中的_________
A.NaOH B.CO2 C.盐酸 D.氨水
熟料溶解时,发生反应的离子方程式为_____________________________________。
(3)母液中溶质主要成分的化学式为__________。溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是_______________________________________________。
Ⅱ. 有100ml某透明溶液,可能含有以下离子中的若干种:Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、HCO3-、SO42-。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.6mol淡黄色粉末时,共收集到0.8mol混合气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.65mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:
(4)淡黄色粉末为_________________;
(5)溶液中肯定有__________________离子;
(6)溶液中阳离子按量由少到多其物质的量之比为______________(H+及没有确定的离子除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L乙烷与2.24L苯含C-H键数均为0.6NA
B. 16.8gFe与足量的水蒸气加热充分反应,转移电子数为0.8NA
C. 25C时,1LpH=7的CH3COONH4溶液中含NH4+数一定为1.0×10-7NA
D. 0.2molCO2与0.1molC在密闭容器中充分反应生成CO分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列有机物:
① CH2=CH2 ②![]()
③ CH3CH(OH)CH2CH3 ④ (CH3)2C=CH2
⑤ CH3CH2OCH2CH3 ⑥ CH3CH=CHCH=CHCOOH
(1)属于羧酸的是_____(填序号)。
(2)与③互为同分异构体的是_____(填序号)。
(3)与①互为同系物的是_____(填序号)。
(4)用系统命名法给④命名,其名称为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需用![]() 的硫酸铜溶液,以下操作正确的是
的硫酸铜溶液,以下操作正确的是![]()
![]()
A. 将![]() 胆矾配成500mL溶液
胆矾配成500mL溶液
B. 将![]() 胆矾溶于少量水中,再用水稀释至500mL
胆矾溶于少量水中,再用水稀释至500mL
C. 称取![]() 硫酸铜,加入500mL水
硫酸铜,加入500mL水
D. 在![]()
![]() 溶液中加入400mL水
溶液中加入400mL水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是几种常见有机物之间的转化关系,下列有关说法正确的是( )
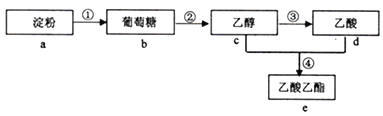
A. 反应①、②、③、④均属于取代反应
B. 反应④的条件为:稀硫酸,加热
C. 与d含有相同官能团的e的同分异构体只有1种
D. a遇碘单质变蓝,b能与银氨溶液水浴加热条件下反应析出银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是石蜡油在炽热碎瓷片的作用下产生C2H4,并检验C2H4性质的实验,完成下列各题。

(1)B 中溶液褪色,原因是______________
(2)C 中反应的化学方程式为_____________
(3)在D 处点燃时必须进行的操作是___________,D 处反应的化学方程式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验需要![]() NaOH溶液475mL和
NaOH溶液475mL和![]() 硫酸溶液
硫酸溶液![]() 根据这两种溶液的配制情况回答下列问题:
根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______![]() 填序号
填序号![]() ,配制上述溶液还需用到的玻璃仪器是______
,配制上述溶液还需用到的玻璃仪器是______![]() 填仪器名称
填仪器名称![]() .
.

(2)下列操作中,不能用容量瓶实现的有______![]() 填序号
填序号![]() .
.
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______![]() 在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______
在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______![]() 填”大于”、“等于”或“小于”,下同
填”大于”、“等于”或“小于”,下同![]() 若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______
若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______![]() .
.
(4)根据计算得知,所需质量分数为![]() 、密度为
、密度为![]() 的浓硫酸的体积为______
的浓硫酸的体积为______![]() 计算结果保留一位小数
计算结果保留一位小数![]() 如果实验室有10mL、15mL、20mL、50mL量筒,选用______mL量筒最好.
如果实验室有10mL、15mL、20mL、50mL量筒,选用______mL量筒最好.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:S(g) + O2 (g) = SO2(g) ΔH=-Q1kJ/mol ; S(s) + O2 (g) = SO2(g) ΔH=-Q2 kJ/mol。 则Q1 Q2
A. 大于 B. 小于 C. 等于 D. 无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com