
【题目】下图是几种常见有机物之间的转化关系,下列有关说法正确的是( )
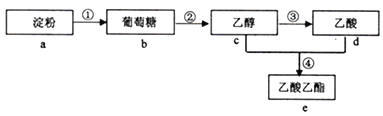
A. 反应①、②、③、④均属于取代反应
B. 反应④的条件为:稀硫酸,加热
C. 与d含有相同官能团的e的同分异构体只有1种
D. a遇碘单质变蓝,b能与银氨溶液水浴加热条件下反应析出银
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]光刻胶的一种合成路线如图:
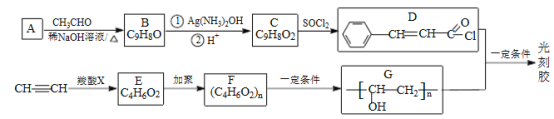
已知:
I. 
Ⅱ. ![]()
Ⅲ.RCOOH+CH≡CH→RCOOCH=CH2
Ⅳ.羧基和酯基不能与氢气发生加成反应。
回答下列问题:
(1)A的名称是_____,C 中所含官能团的名称是__________。
(2)由C生成D、乙炔生成E的反应类型分别为_____ 、_____ 。
(3)E的结构简式为_____ 。
(4)D+G→光刻胶的化学方程式为__________。
(5)T是C的同分异构体,T 具有下列性质或特征: ①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物。其中核磁共振氢谱为5组峰,且峰面积比为1:1:2:2:2的结构简式为_____________。
(6)写出用乙醛和丙炔为原料制备化合物CH3CH2CH2COOCH2CH2CH3的合成路线__________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 阿伏加德罗常数是12g碳中所含有的碳原子数
B. 已知微粒个数,可通过阿伏加德罗常数计算出微粒的物质的量
C. 阿伏加德罗常数的数值是6.02×1023
D. 阿伏加德罗常数的符号为NA,通常用6.02×1023表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量是 ______ 的物质所具有的质量![]() 符号: ______
符号: ______ ![]() 单位: ______ 或 ______ .
单位: ______ 或 ______ .
A. 单位物质的量;M;![]() ;
;![]()
B. 物质的量;m;![]() ;
;![]()
C. 单位物质的量;m;g;![]()
D. 物质的量;M;![]() ;kg
;kg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
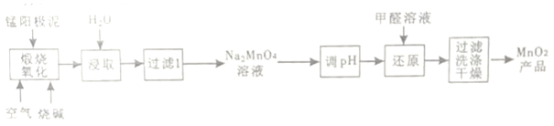
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯因研制合成氨作出重大贡献而获得1918年诺贝尔化学奖,如今可以用电化学的方法合成氨,装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( )
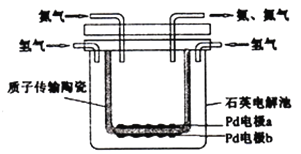
A. Pd电极b为阴极 B. 阴极的反应式为:N2+6H++6e-=2NH3
C. H+由阳极向阴极迁移 D. 陶瓷可以隔离N2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去甲烷中混有的乙烯,得到纯净的甲烷,最好依次通过( )
A.溴水,烧碱溶液,浓H2SO4
B.酸性KMnO4溶液,浓H2SO4
C.澄清石灰水,浓H2SO4
D.浓H2SO4 , 酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com