
| 2×10-4g |
| 2mL |


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:
| A、X与Y形成的分子中既含有极性共价键又含有非极性共价键 |
| B、X的气态氢化物比Y的气态氢化物稳定 |
| C、X与R、Y与R均能形成阴阳离子数目之比为1:1的化合物 |
| D、R、X、Y三种元素可形成化学式为RXY3、R(X2Y4)2的两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C(H+)?C(CH3COO-) |
| C(CH3COOH) |
| C(H+)?C(HS-) |
| C(H2S) |
| C(H+)?C(S2-)2- |
| C(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
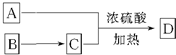 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷和乙烯 |
| B、甲烷和丙烯 |
| C、甲烷和丁烯 |
| D、乙烷和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
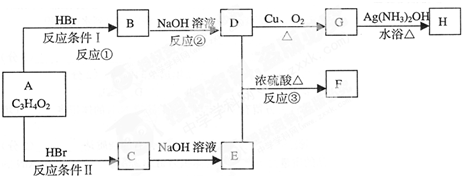
查看答案和解析>>
科目:高中化学 来源: 题型:
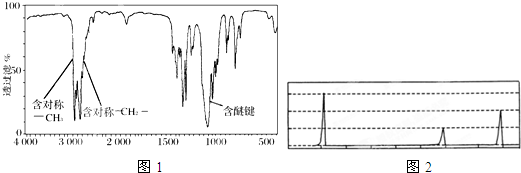
查看答案和解析>>
科目:高中化学 来源: 题型:
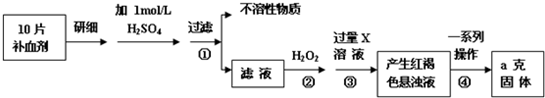
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学在探究常见物质转化时,发现部分物质间可存在如图所示的三角转换关系.已知:
某同学在探究常见物质转化时,发现部分物质间可存在如图所示的三角转换关系.已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com