
【题目】以下离子方程式书写正确的是
A.用醋酸除去水垢:2H+ + CaCO3 = Ca2++CO2↑+H2O
B.向NH4HCO3溶液中加入足量石灰水:Ca2+ + HCO3-+OH-= CaCO3↓ + H2O
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3 ↓
=Al2(CO3)3 ↓
D.侯氏制碱法中NaHCO3的制备:Na+ + NH3 + CO2 + H2O = NaHCO3 ↓ + NH4+
【答案】D
【解析】
A.醋酸是弱酸,不能拆成离子形式,故离子方程式为,2CH3COOH+CaCO3= Ca2++CO2↑+H2O+2CH3COO-,故A错误;
B.向碳酸氢铵溶液中加入足量石灰水,反应生成碳酸钙沉淀、一水合氨和水,正确的离子方程式为:NH4++Ca2++HCO3+2OH═CaCO3↓+H2O+NH3H2O,故B错误;
C.向硫酸铝溶液中滴加碳酸钠溶液,发生双水解反应,生成氢氧化铝沉淀和二氧化碳气体,故C错误;
D.向饱和氯化钠的氨水溶液中通入二氧化碳,反应生成碳酸氢钠晶体,反应的离子方程式为:Na+ +NH3 +CO2+H2O = NaHCO3 ↓ + NH4+,符合客观事实,电荷守恒,原子守恒,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】纳米级TiO2具有独特的光催化性与紫外线屏蔽等功能、具有广阔的工业应用前景。实验室用钛铁精矿(FeTiO3)提炼TiO2的流程如下。下列说法错误的是( )

A.酸浸的化学方程式是:FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
B.X稀释所得分散系含纳米级H2TiO3,可用于观察丁达尔效应
C.②用水蒸气是为了促进水解,所得稀硫酸可循环使用
D.①③反应中至少有一个是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学习小组设计的利用氨气进行喷泉实验的装置示意图。

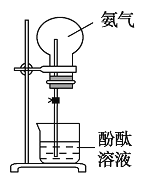
A B
请回答下列问题:
(1)学生甲用装置![]() 进行喷泉实验,上部烧瓶已充满干燥的氨气,引发喷泉的操作是________________________________________________________________________。
进行喷泉实验,上部烧瓶已充满干燥的氨气,引发喷泉的操作是________________________________________________________________________。
(2)学生乙将装置![]() 误装为装置
误装为装置![]() ,但经与同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法与原理:_________________________________。
,但经与同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法与原理:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有MgCO3固体的浊液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A.c(Mg2+)B.Ksp(MgCO3)C.c(H+)D.c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.水溶液中:K+、Na+、SO42、MnO4-
B.滴加KSCN显红色的溶液:NH4+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1×10-14的溶液中:Cu2+、K+、SO42、NO3-
D.无色透明的溶液中:Fe3+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.金属冶炼与处理中常涉及离子反应和氧化还原反应。
(1)实验室常用无水乙醇处理少量残留的金属钠,写出反应的化学方程式_________。
(2)镁与碳在加强热时可生成易水解的MgC2,其水解的化学方程式为________。
(3)我国古代劳动人民曾利用明矾溶液除去铜器表面的铜锈[Cu2(OH)2CO3],请简要解释其原理:_______。
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序是:______________。
(5)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
A 容器内的混合气体的平均相对分子质量保持不变
B 水分子中断裂2NA个H-O键,同时氢分子中生成3NA个H-H键
C CH3OH和H2O的浓度保持不变
D 容器内的混合气体的密度保持不变
(6)现有反应CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 0.9 | 0.9 | 1.2 |
此时v正_______v逆(填“>”、“<”或“=”),v (CH3OH) =_______;当反应达到平衡状态时,混合气体中CH3OCH3体积分数(CH3OCH3)%=______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C为同一短周期金属元素。依据下表数据分析,A、B、C三种元素的离子半径由大到小的顺序是_____。(用离子符号表示)
电离能/kJmol-1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
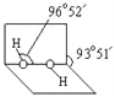
(2)已知H2O2分子的空间结构如图所示,H2O2分子中氧原子采取____________杂化;H2O2分子是______(填“极性分子”或“非极性分子”)。
(3)R是第4周期元素中未成对电子数最多的原子。R3+在溶液中存在如下转化:
R3+![]() R(OH)3
R(OH)3![]() [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为_____。
②[R(OH)4]-中存在的化学键是_____;1mol[R(OH)4]-离子中含有σ键的数目为_______mol。
A.离子键 B.极性键 C.非极性键D .配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“盐泥”是氯碱工业中产生的。盐泥中含 NaCl(15%~20%)、Mg(OH)2(15%~20%)、
CaCO3(15%~20%)和BaSO4 等不溶于酸的物质。用“盐泥”生产七水硫酸镁,设计了如下工艺流程:
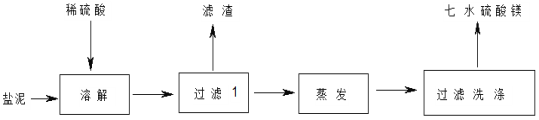
(1)电解食盐水前,为除去粗食盐水中的 Mg2+、Ca2+、SO42-等杂质离子,下列试剂加入的先后顺序合理的是_____(填序号)。
A.碳酸钠溶液 B.氢氧化钠溶液 C.氯化钡溶液 D.盐酸
(2)已知Ksp[Mg(OH)2]=6.0×10-12。设食盐水中 Mg2+的浓度为 0.06 mol·L-1,则加入氢氧化钠溶液后使溶液的 pH≥_____才可能产生 Mg(OH)2 沉淀。
(3)氯碱工业上电解食盐水阴极发生的反应是_____。
(4)三种化合物的溶解度(S)随温度变化曲线见下图

在“过滤Ⅰ” 中需要趁热过滤,其主要原因是_________;滤渣的主要成分有不溶于酸的物质、_________。
(5)检验 MgSO4·7H2O 中杂质是否洗涤干净的操作是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.2000mol/L NaOH 溶液滴定20.00mL 0.2000mol/L HCl溶液,滴定曲线如图所示,下列说法不正确的是
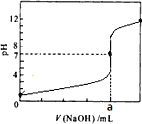
A.a=20.00
B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C.若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a<20.00
D.若用酚酞作指示剂,当滴定到溶液明显由无色变为浅红色时立即停止滴定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com