
【题目】Ⅰ.金属冶炼与处理中常涉及离子反应和氧化还原反应。
(1)实验室常用无水乙醇处理少量残留的金属钠,写出反应的化学方程式_________。
(2)镁与碳在加强热时可生成易水解的MgC2,其水解的化学方程式为________。
(3)我国古代劳动人民曾利用明矾溶液除去铜器表面的铜锈[Cu2(OH)2CO3],请简要解释其原理:_______。
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序是:______________。
(5)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
A 容器内的混合气体的平均相对分子质量保持不变
B 水分子中断裂2NA个H-O键,同时氢分子中生成3NA个H-H键
C CH3OH和H2O的浓度保持不变
D 容器内的混合气体的密度保持不变
(6)现有反应CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 0.9 | 0.9 | 1.2 |
此时v正_______v逆(填“>”、“<”或“=”),v (CH3OH) =_______;当反应达到平衡状态时,混合气体中CH3OCH3体积分数(CH3OCH3)%=______%。
【答案】2Na + 2CH3CH2OH ═ 2CH3CH2ONa + H2 ↑ MgC2 + 2H2O ═ Mg(OH)2 + C2H2 ↑ 明矾中的Al3+发生水解反应使溶液呈酸性,能使Cu2(OH)2CO3溶解 c(Na+)>c(![]() )>c(OH-)>c(
)>c(OH-)>c(![]() )>c(H+) AC < 0.12mol·L-1·min-1 20%
)>c(H+) AC < 0.12mol·L-1·min-1 20%
【解析】
Ⅰ.(1)乙醇和钠反应生成乙醇钠和氢气;
(2)MgC2水解生成氢氧化镁和乙炔;
(3)明矾溶液中铝离子水解表现酸性,能使Cu2(OH)2CO3溶解;
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,生成Na2CO3溶液,根据盐类水解规律进行分析溶液中离子浓度由大到小的顺序;
(5)根据反应达到平衡状态的标志:正逆反应速率相等,各组分的浓度保持不变,以及由此衍生出的其它物理量进行分析;
(6)根据CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) 反应, 根据Qc与K的关系进行分析。
2CH3OH(g) 反应, 根据Qc与K的关系进行分析。
Ⅰ.(1)实验室常用无水乙醇处理少量残留的金属钠,写出反应的化学方程式2Na + 2CH3CH2OH ═ 2CH3CH2ONa + H2 ↑;
故答案为:2Na + 2CH3CH2OH ═ 2CH3CH2ONa + H2 ↑;
(2)MgC2水解生成氢氧化镁和乙炔,化学方程式为MgC2 + 2H2O ═ Mg(OH)2 + C2H2 ↑ ;
故答案为:MgC2 + 2H2O ═ Mg(OH)2 + C2H2 ↑;
(3)明矾溶液除去铜器表面的铜锈,因为铝离子水解表现酸性,能使Cu2(OH)2CO3溶解;
故答案为:明矾中的Al3+发生水解反应使溶液呈酸性,能使Cu2(OH)2CO3溶解;
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,生成Na2CO3,溶液中离子浓度由大到小的顺序是c(Na+)>c(![]() )>c(OH-)>c(
)>c(OH-)>c(![]() )>c(H+);
)>c(H+);
故答案为:c(Na+)>c(![]() )>c(OH-)>c(
)>c(OH-)>c(![]() )>c(H+);
)>c(H+);
(5)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
A.反应物,生成物都是气体,气体的质量不变,当相对分子质量不变,说明气体的总物质的量不变,能说明反应达到平衡状态,故A正确;
B.水分子中断裂2NA个H-O键,同时氢分子中生成3NA个H-H键,指的是同一个方向,不能说明处于平衡状态,故B错误;
C.CH3OH和H2O的浓度保持不变,说明可逆反应处于平衡状态,故C正确;
D.反应物是气体,生成物是气体,总质量不变,容积不变,混合气体的密度保持不变,不能说明反应达到平衡状态,故D错误;
故答案为:AC;
(6)CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) , Qc=
2CH3OH(g) , Qc=  =1.22/0.92=1.8>0.25,可逆反应向逆反应方向进行,故v正<v逆;反应到10min时,CH3OH的变化量为1.2mol/L,所以,v (CH3OH)=
=1.22/0.92=1.8>0.25,可逆反应向逆反应方向进行,故v正<v逆;反应到10min时,CH3OH的变化量为1.2mol/L,所以,v (CH3OH)=![]() =0.12mol·L-1·min-1;
=0.12mol·L-1·min-1;
根据反应以上的分析可知,该反应正在向左进行,
CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g)
2CH3OH(g)
起始浓度 0.9 0.9 1.2
变化浓度 x x 2x
平衡浓度 0.9+x 0.9+x 1.2-2x
由于温度不变,平衡常数为0.25,所以K=![]() =
= 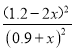 =0.25,x=0.3,混合气体中CH3OCH3体积分数(CH3OCH3)%=
=0.25,x=0.3,混合气体中CH3OCH3体积分数(CH3OCH3)%=![]() ×100%=20%;
×100%=20%;
故答案是:<;0.12mol·L-1·min-1;20%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___,二氯胺与水反应的化学方程式为___。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。
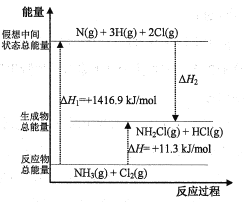
化学键 | N-H | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=___kJ/mol,x=___。
(3)在密闭容器中反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随![]() (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
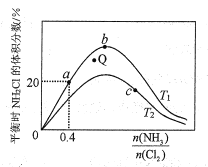
①a、b、c三点对应平衡常数的大小关系是___。T1温度下该反应的平衡常数为___(列出算式即可)。
②在T2温度下,Q点对应的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___(任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
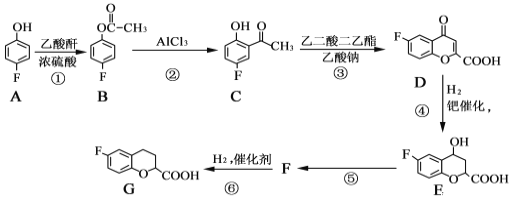
已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是_________________;B中所含官能团的名称是____________。
(2)反应⑤的化学方程式为____________________________,反应①的反应类型是_______________。
(3)D 的分子式为_____________。
(4)写出满足下列条件的E的同分异构体的结构简式:_________ 、________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备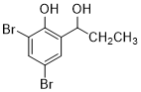 的合成路线流程图(无机试剂任选)___________________合成路线流程图示:CH3CH2Br
的合成路线流程图(无机试剂任选)___________________合成路线流程图示:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
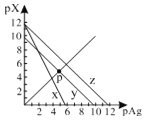
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下离子方程式书写正确的是
A.用醋酸除去水垢:2H+ + CaCO3 = Ca2++CO2↑+H2O
B.向NH4HCO3溶液中加入足量石灰水:Ca2+ + HCO3-+OH-= CaCO3↓ + H2O
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3 ↓
=Al2(CO3)3 ↓
D.侯氏制碱法中NaHCO3的制备:Na+ + NH3 + CO2 + H2O = NaHCO3 ↓ + NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是( )
A.50mL12mol·L-1的浓盐酸与足量MnO2共热,制得Cl2的分子数目小于0.15NA
B.10g46%乙醇水溶液中所含氧原子数为0.4NA
C.1L1mol/LNa2CO3溶液中,阴离子总数小于NA
D.浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 可以写成
可以写成![]() ,从某些性质看,
,从某些性质看,![]() 和
和![]() ,
,![]() 和
和![]() ,
,![]() 和
和![]() ,
,![]() 和
和![]() 两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
①![]()
②![]()
③![]()
④![]()
A.仅①B.仅②④C.全部D.仅①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分Al2O3、Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
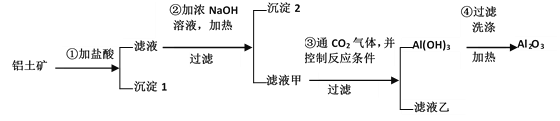
(1)写出步骤①中所发生反应的化学方程式____
(2)沉淀1是_________(写化学式);沉淀2是________(写化学式)。
(3)写出步骤②中所发生反应的离子方程式__________
(4)用氧化铝冶炼铝的化学方程式是______
(5)请设计另一个实验方案提取氧化铝________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液。C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH![]() 2K2FeO4+6KCl+8H2O,另外还有________________。
2K2FeO4+6KCl+8H2O,另外还有________________。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。
②根据K2FeO4的制备实验得出:氧化性Cl2________![]() (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和![]() 的氧化性强弱关系相反,原因是________________。
的氧化性强弱关系相反,原因是________________。
③资料表明,酸性溶液中的氧化性![]() >
>![]() ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性![]() >
>![]() 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com