
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是( )
A.50mL12mol·L-1的浓盐酸与足量MnO2共热,制得Cl2的分子数目小于0.15NA
B.10g46%乙醇水溶液中所含氧原子数为0.4NA
C.1L1mol/LNa2CO3溶液中,阴离子总数小于NA
D.浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
【答案】C
【解析】
A.50 mL 12 molL-1 浓盐酸中含有0.6mol氯化氢,消耗0.6mol氯化氢生成0.15mol氯气,但由于随着反应的进行浓盐酸变为稀盐酸,而稀盐酸与二氧化锰不反应,所以制得Cl2的分子数目小于0.15NA,故A选项正确。
B.10g质量分数为46%的乙醇中含有乙醇的质量为4.6g,乙醇的物质的量为0.1mol,含有0.1mol氧原子;该乙醇溶液中水分子的质量分数为54%,则水的物质的量为: ![]() ,含有0.3mol氧原子,则该乙醇溶液中总共含有氧原子的物质的量为0.4mol,含有的氧原子的总数为0.4NA,故B选项正确。
,含有0.3mol氧原子,则该乙醇溶液中总共含有氧原子的物质的量为0.4mol,含有的氧原子的总数为0.4NA,故B选项正确。
C. 因为CO32-水解生成了OH-和HCO3-,可见一个阴离子水解生成两个阴离子,所以1L 1mol·L-1碳酸钠溶液中阴离子总数大于NA,故C选项错误。
D.23gNO2与N2O4的混合气体中含有0.5mol最简式NO2,浓硝酸热分解的过程中N的化合价由+5降低到+4,故转移0.5mol电子,转移电子数为0.5NA,故D选项正确。
故答案选C。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L的NaCl溶液
B.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L
C.将w g a%的NaCl溶液蒸发掉![]() g水,得到2a%的NaCl溶液
g水,得到2a%的NaCl溶液
D.将1体积c1 mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3
C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图或曲线图与对应的叙述相符的是
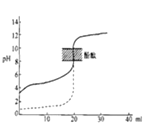
A.如下图所示,用 0.1 mol·L-1 NaOH 溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
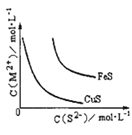
B.某温度下 FeS、CuS 的沉淀溶解平衡曲线如下图 所示。在物质的量浓度相等的 Fe2+和 Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为 Fe2+
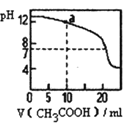
C.如下图 所示,用 0.1 mol·L-1CH3COOH 溶液滴定 20 mL 0.1 mol·L-1 NaOH 溶液的滴定曲线, 当 pH=7 时:c(Na+) = c(CH3COO-) > c(OH-) = c(H+)
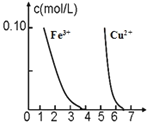
D.据下图,若除去CuSO4 溶液中的 Fe3+可向溶液中加入适量CuO 至 pH 在 5.8 左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.金属冶炼与处理中常涉及离子反应和氧化还原反应。
(1)实验室常用无水乙醇处理少量残留的金属钠,写出反应的化学方程式_________。
(2)镁与碳在加强热时可生成易水解的MgC2,其水解的化学方程式为________。
(3)我国古代劳动人民曾利用明矾溶液除去铜器表面的铜锈[Cu2(OH)2CO3],请简要解释其原理:_______。
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序是:______________。
(5)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
A 容器内的混合气体的平均相对分子质量保持不变
B 水分子中断裂2NA个H-O键,同时氢分子中生成3NA个H-H键
C CH3OH和H2O的浓度保持不变
D 容器内的混合气体的密度保持不变
(6)现有反应CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 0.9 | 0.9 | 1.2 |
此时v正_______v逆(填“>”、“<”或“=”),v (CH3OH) =_______;当反应达到平衡状态时,混合气体中CH3OCH3体积分数(CH3OCH3)%=______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中过量的氨氮(![]() 和
和![]() )会导致水体富营养化。某科研小组用
)会导致水体富营养化。某科研小组用![]() 氧化法处理氨氮废水。已知:①
氧化法处理氨氮废水。已知:①![]() 的氧化性比
的氧化性比![]() 强;②
强;②![]() 比
比![]() 更易被氧化;③国家相关标准要求经处理过的氨氮废水
更易被氧化;③国家相关标准要求经处理过的氨氮废水![]() 要控制在6~9 。
要控制在6~9 。
(1)![]() 时,
时,![]() 可与
可与![]() 反应生成
反应生成![]() 等无污染物质,该反应的离子方程式为___________。
等无污染物质,该反应的离子方程式为___________。
(2)进水![]() 对氨氮去除率和出水pH的影响分别如图1和图2所示:
对氨氮去除率和出水pH的影响分别如图1和图2所示:
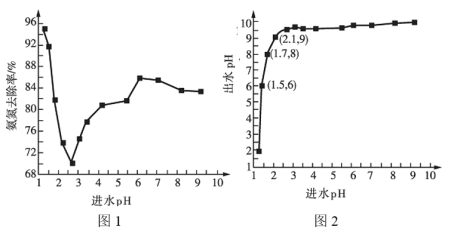
①进水![]() 在1.25~2.75范围内时,氨氮去除率随
在1.25~2.75范围内时,氨氮去除率随![]() 的升高迅速下降的原因是__________。
的升高迅速下降的原因是__________。
②进水![]() 在2.75~6范围内时,氨氮去除率随
在2.75~6范围内时,氨氮去除率随![]() 的升高而上升的原因是___________。
的升高而上升的原因是___________。
③进水![]() 应控制在____________左右为宜。
应控制在____________左右为宜。
(3)为研究空气对![]() 氢化氨氮的影响,其他条件不变,仅增加单位时间内通人空气的量,发现氨氮去除率几乎不变。其原因可能是______(填序号)
氢化氨氮的影响,其他条件不变,仅增加单位时间内通人空气的量,发现氨氮去除率几乎不变。其原因可能是______(填序号)
a.![]() 的氧化性比
的氧化性比![]() 弱
弱
b.![]() 氧化氨氮速率比
氧化氨氮速率比![]() 慢
慢
c.![]() 在废水中溶解度比较小
在废水中溶解度比较小
d.空气中的![]() 进入废水中
进入废水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2所示装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
②_________________________________________________。
(2)能说明有SO2气体产生的实验现象是_________________________。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴人适量水中为试样,试样中所含金属离子的成分有以下三种可能:
I.只含有Fe3+;II.只含有Fe2+;III.既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀盐酸溶液 B.稀硫酸溶液 C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉—KI溶液 G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的____________(填试剂序号,下同),振荡,再滴加少量的___________,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤l 取试样,滴加少量的______________(填试剂序号),溶液的颜色变____色,则试样中含有Fe3+,发生反应的离子方程式为________。
步骤2 再取适量的试样滴加少量的_______________________ (填试剂序号),溶液的颜色变为_____________,则试样中含有Fe2+。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com