
【题目】废水中过量的氨氮(![]() 和
和![]() )会导致水体富营养化。某科研小组用
)会导致水体富营养化。某科研小组用![]() 氧化法处理氨氮废水。已知:①
氧化法处理氨氮废水。已知:①![]() 的氧化性比
的氧化性比![]() 强;②
强;②![]() 比
比![]() 更易被氧化;③国家相关标准要求经处理过的氨氮废水
更易被氧化;③国家相关标准要求经处理过的氨氮废水![]() 要控制在6~9 。
要控制在6~9 。
(1)![]() 时,
时,![]() 可与
可与![]() 反应生成
反应生成![]() 等无污染物质,该反应的离子方程式为___________。
等无污染物质,该反应的离子方程式为___________。
(2)进水![]() 对氨氮去除率和出水pH的影响分别如图1和图2所示:
对氨氮去除率和出水pH的影响分别如图1和图2所示:
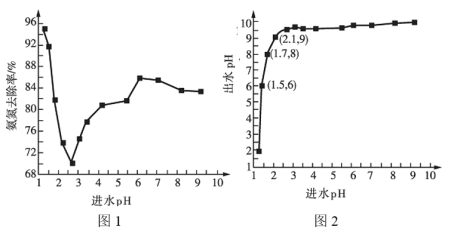
①进水![]() 在1.25~2.75范围内时,氨氮去除率随
在1.25~2.75范围内时,氨氮去除率随![]() 的升高迅速下降的原因是__________。
的升高迅速下降的原因是__________。
②进水![]() 在2.75~6范围内时,氨氮去除率随
在2.75~6范围内时,氨氮去除率随![]() 的升高而上升的原因是___________。
的升高而上升的原因是___________。
③进水![]() 应控制在____________左右为宜。
应控制在____________左右为宜。
(3)为研究空气对![]() 氢化氨氮的影响,其他条件不变,仅增加单位时间内通人空气的量,发现氨氮去除率几乎不变。其原因可能是______(填序号)
氢化氨氮的影响,其他条件不变,仅增加单位时间内通人空气的量,发现氨氮去除率几乎不变。其原因可能是______(填序号)
a.![]() 的氧化性比
的氧化性比![]() 弱
弱
b.![]() 氧化氨氮速率比
氧化氨氮速率比![]() 慢
慢
c.![]() 在废水中溶解度比较小
在废水中溶解度比较小
d.空气中的![]() 进入废水中
进入废水中
【答案】![]() 随着
随着![]() 的升高,
的升高,![]() 含量增大,氧化性降低,导致氨氯去除率下降 随着
含量增大,氧化性降低,导致氨氯去除率下降 随着![]() 的升高,氨氮废水中
的升高,氨氮废水中![]() 含量增大,而
含量增大,而![]() 比
比![]() 更易被氧化 1.5
更易被氧化 1.5 ![]()
【解析】
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,次氯酸根离子被还原为氯离子和水,结合电荷守恒、电子守恒、原子守恒配平书写离子方程式;
(2)①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降是c(OH-)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱;
②进水pH为2.75~6.00范围内氨氮去除率随pH升高而上升,氨气含量增大氨氮易被氧化;
③结合图象变化可知进水pH应控制在1.0左右;
(3)其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变,说明O2氧化氨氮速率比NaClO慢,比次氯酸钠氧化性弱,溶液中溶解的氧气少等原因。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,次氯酸根离子被还原为氯离子,结合电荷守恒、电子守恒、原子守恒配平书写离子方程式:3ClO-+2NH4+=N2↑+3Cl-+2H+;
(2)①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是:随着PH升高,NaClO含量增大,氧化性能降低,导致氨氮去除率下降;
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是:随着PH升高氨氮废水中氨气含量增大,氨氮更易被氧化;
③进水pH应控制在1.50左右,氨氮去除率会较大;
(3)研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是:O2的氧化性比NaClO弱、O2氧化氨氮速率比NaClO慢、O2在溶液中溶解度比较小;故答案为:abc。


科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色 沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D的分子式分别为:A__________B_________C___________D_________。
(2)写出下列各反应的化学方程式:
A与B_______________________________________________
B与水_______________________________________________
B与NaOH溶液_______________________________________
C与澄清石灰水_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
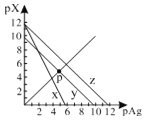
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是( )
A.50mL12mol·L-1的浓盐酸与足量MnO2共热,制得Cl2的分子数目小于0.15NA
B.10g46%乙醇水溶液中所含氧原子数为0.4NA
C.1L1mol/LNa2CO3溶液中,阴离子总数小于NA
D.浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 可以写成
可以写成![]() ,从某些性质看,
,从某些性质看,![]() 和
和![]() ,
,![]() 和
和![]() ,
,![]() 和
和![]() ,
,![]() 和
和![]() 两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
①![]()
②![]()
③![]()
④![]()
A.仅①B.仅②④C.全部D.仅①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO47H2O)和KClO3在水溶液中反应得到。下列说法不正确的是( )
A.KClO3作氧化剂,每生成1mol[Fe(OH)SO4]n消耗![]() molKClO3
molKClO3
B.生成聚合硫酸铁后,水溶液的pH一定增大
C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水
D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分Al2O3、Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
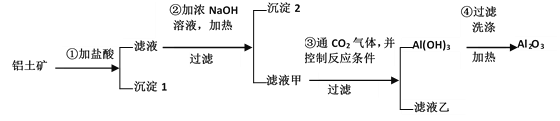
(1)写出步骤①中所发生反应的化学方程式____
(2)沉淀1是_________(写化学式);沉淀2是________(写化学式)。
(3)写出步骤②中所发生反应的离子方程式__________
(4)用氧化铝冶炼铝的化学方程式是______
(5)请设计另一个实验方案提取氧化铝________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废金属屑中主要成分为Cu、Fe和Al(含有少量Al2O3和Fe2O3),某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
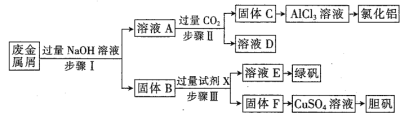
请回答:
(1)胆矾的化学式为___________________。
(2)溶液E为绿色溶液,则试剂X是______________。
(3)步骤I,首先加入温热NaOH溶液,作用是_________;-段时间后,再分批加入常温NaOH溶液,原因是___________。
(4)在步骤II时,用如图装置制取CO2并通入溶液A中。-段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加-个盛有饱和_________溶液的洗气瓶。
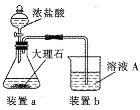
(5)保存FeSO4溶液时,需要滴加少量硫酸溶液,再加入适量_______(填化学式),防止变质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两极质量相同的铜棒和锌棒,用导线相连接后插入CuSO4溶液中,经过一段时间后,取出洗净后干燥并称重,两棒质量相差6.45 g,导线中通过的电子的物质的量为 ( )
A.0.1 molB.0.2 molC.0.3 molD.0.4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com