
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液。C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH![]() 2K2FeO4+6KCl+8H2O,另外还有________________。
2K2FeO4+6KCl+8H2O,另外还有________________。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。
②根据K2FeO4的制备实验得出:氧化性Cl2________![]() (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和![]() 的氧化性强弱关系相反,原因是________________。
的氧化性强弱关系相反,原因是________________。
③资料表明,酸性溶液中的氧化性![]() >
>![]() ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性![]() >
>![]() 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:________________。
【答案】 2KMnO4+16HCl![]() 2MnCl2+2KCl +5Cl2↑+8H2O
2MnCl2+2KCl +5Cl2↑+8H2O  Cl2+2OH
Cl2+2OH![]() Cl+ClO+H2O Fe3+ 4FeO42+20H+
Cl+ClO+H2O Fe3+ 4FeO42+20H+![]() 4Fe3++3O2↑+10H2O 排除ClO的干扰 > 溶液的酸碱性不同 若能,理由:FeO42在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO4的颜色(若不能,方案:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色)
4Fe3++3O2↑+10H2O 排除ClO的干扰 > 溶液的酸碱性不同 若能,理由:FeO42在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO4的颜色(若不能,方案:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色)
【解析】分析:(1)KMnO4与浓盐酸反应制Cl2;由于盐酸具有挥发性,所得Cl2中混有HCl和H2O(g),HCl会消耗Fe(OH)3、KOH,用饱和食盐水除去HCl;Cl2与Fe(OH)3、KOH反应制备K2FeO4;最后用NaOH溶液吸收多余Cl2,防止污染大气。
(2)①根据制备反应,C的紫色溶液中含有K2FeO4、KCl,Cl2还会与KOH反应生成KCl、KClO和H2O。
I.加入KSCN溶液,溶液变红说明a中含Fe3+。根据题意K2FeO4在酸性或中性溶液中快速产生O2,自身被还原成Fe3+。
II.产生Cl2还可能是ClO-+Cl-+2H+=Cl2↑+H2O,即KClO的存在干扰判断;K2FeO4微溶于KOH溶液,用KOH洗涤除去KClO、排除ClO-的干扰,同时保持K2FeO4稳定存在。
②根据同一反应中,氧化性:氧化剂![]() 氧化产物。对比两个反应的异同,制备反应在碱性条件下,方案II在酸性条件下,说明酸碱性的不同影响氧化性的强弱。
氧化产物。对比两个反应的异同,制备反应在碱性条件下,方案II在酸性条件下,说明酸碱性的不同影响氧化性的强弱。
③判断的依据是否排除FeO42-的颜色对实验结论的干扰。
详解:(1)①A为氯气发生装置,KMnO4与浓盐酸反应时,锰被还原为Mn2+,浓盐酸被氧化成Cl2,KMnO4与浓盐酸反应生成KCl、MnCl2、Cl2和H2O,根据得失电子守恒和原子守恒,反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O。
②由于盐酸具有挥发性,所得Cl2中混有HCl和H2O(g),HCl会消耗Fe(OH)3、KOH,用饱和食盐水除去HCl,除杂装置B为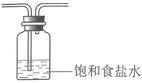 。
。
③ C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,还有Cl2与KOH的反应,Cl2与KOH反应的化学方程式为Cl2+2KOH=KCl+KClO+H2O,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(2)①根据上述制备反应,C的紫色溶液中含有K2FeO4、KCl,还可能含有KClO等。
i.方案I加入KSCN溶液,溶液变红说明a中含F3+。但Fe3+的产生不能判断K2FeO4与Cl-发生了反应,根据题意K2FeO4在酸性或中性溶液中快速产生O2,自身被还原成Fe3+,根据得失电子守恒、原子守恒和电荷守恒,可能的反应为4FeO42-+20H+=3O2↑+4Fe3++10H2O。
ii.产生Cl2还可能是ClO-+Cl-+2H+=Cl2↑+H2O,即KClO的存在干扰判断;K2FeO4微溶于KOH溶液,用KOH溶液洗涤的目的是除去KClO、排除ClO-的干扰,同时保持K2FeO4稳定存在。
②制备K2FeO4的原理为3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,在该反应中Cl元素的化合价由0价降至-1价,Cl2是氧化剂,Fe元素的化合价由+3价升至+6价,Fe(OH)3是还原剂,K2FeO4为氧化产物,根据同一反应中,氧化性:氧化剂![]() 氧化产物,得出氧化性Cl2
氧化产物,得出氧化性Cl2![]() FeO42-;方案II的反应为2FeO42-+6Cl-+16H+=2Fe3++3Cl2↑+8H2O,实验表明,Cl2和FeO42-氧化性强弱关系相反;对比两个反应的条件,制备K2FeO4在碱性条件下,方案II在酸性条件下;说明溶液的酸碱性的不同影响物质氧化性的强弱。
FeO42-;方案II的反应为2FeO42-+6Cl-+16H+=2Fe3++3Cl2↑+8H2O,实验表明,Cl2和FeO42-氧化性强弱关系相反;对比两个反应的条件,制备K2FeO4在碱性条件下,方案II在酸性条件下;说明溶液的酸碱性的不同影响物质氧化性的强弱。
③该小题为开放性试题。若能,根据题意K2FeO4在足量H2SO4溶液中会转化为Fe3+和O2,最后溶液中不存在FeO42-,溶液振荡后呈浅紫色一定是MnO4-的颜色,说明FeO42-将Mn2+氧化成MnO4-,所以该实验方案能证明氧化性FeO42-![]() MnO4-。(或不能,因为溶液b呈紫色,溶液b滴入MnSO4和H2SO4的混合溶液中,c(FeO42-)变小,溶液的紫色也会变浅;则设计一个空白对比的实验方案,方案为:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色)。
MnO4-。(或不能,因为溶液b呈紫色,溶液b滴入MnSO4和H2SO4的混合溶液中,c(FeO42-)变小,溶液的紫色也会变浅;则设计一个空白对比的实验方案,方案为:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色)。


科目:高中化学 来源: 题型:
【题目】将盛有氮气和二氧化氮混合气体的试管(试管容积为VL)倒立于水中,经过足够长的时间后,试管内气体的体积变为aL。请回答下列问题:
(1)该混合气体倒立于水中发生反应的化学方程式是______________________。
(2)若a=![]() V,则原混合气体中氮气与二氧化氮的体积之比是__________。
V,则原混合气体中氮气与二氧化氮的体积之比是__________。
(3)结合第(2)小题,向aL气体中通入氧气至试管中刚好只有一种气体时,停止通入氧气。
①试管中最终剩余的气体是____________,其体积是____________。
②该过程中总反应的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:

(1)NH4Al(SO4)2可作净水剂,其理由是________________________________________________________ (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() )__________(填“等于”、“大于”或“小于”) 0.1 mol/L (NH4)2SO4溶液中的c(
)__________(填“等于”、“大于”或“小于”) 0.1 mol/L (NH4)2SO4溶液中的c(![]() )。
)。
(3)如图1是0.1 mol/L电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是__________(填写字母),导致pH随温度变化的原因是_____________________________________________________________;
②20℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )c(
)c(![]() )3c(Al3+)=_________(填数值)。
)3c(Al3+)=_________(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是______;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
![]()
(1)乙是PVC的单体,其结构简式为_____________________;
(2)反应①的化学方程式为______________________________________________________;
(3)写出以下反应类型:反应②_________________;反应③_________________。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸( )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,请写出DMP的结构简式为________________。
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,请写出DMP的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. c(Fe2+) =1 mol·L1的溶液中:K+、Fe3+、ClO-、SO42-
B. 0.1 mol·L1NH4Cl溶液中:Ba2+、OH-、AlO2-、NO3-
C. ![]() =1×10 12的溶液中:Na +、SO42-、Al3+、NO3-
=1×10 12的溶液中:Na +、SO42-、Al3+、NO3-
D. 由水电离的c(H+)=1×10 13mol·L1溶液中:Na+、K+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素指周期表中倒数第二列的元素,它们的化合物在生活生产中都有很重要的作用.氯化钾是临床常用的电解质平衡调节药,广泛用于临床各科,也常用于无机工业,是制造各种钾盐或碱如氢氧化钾、硫酸钾、硝酸钾、氯酸钾、红矾钾等的基本原料.
Ⅰ.老卤中主要含KCl和少量MgCl2、CaCl2、MgSO4等,需要分离提纯得到KCl.现有几种试剂:①盐酸;②K2CO3;③Na2CO3;④NaOH;⑤KOH;⑥Ba(OH)2;⑦BaCl2;⑧Ba(NO3)2 .
(1)为有效除去老卤中的杂质,加入试剂的合理顺序为_________.
A.先加NaOH,后加Na2CO3,再加BaCl2
B.先加BaCl2,后加NaOH,再加Na2CO3
C.先加K2CO3,后加KOH,再加Ba(NO3)2
D.先加Ba(NO3)2,后加K2CO3,再加KOH
E.先加Ba(OH)2,后加K2CO3
(2)过滤除去沉淀后还需要加入的试剂为______ (填序号),还需要进行的实验为_____.
A.蒸发结晶 B.降温结晶
Ⅱ.现有如下图仪器:

(1)仪器F的名称是_________.
(2)在实验室组成一套蒸馏装置肯定需要所给仪器中的一部分,按照实验仪器由下到上、从左到右的顺序,这些仪器依次是____________(填字母).
Ⅲ.小明同学将16.0 g NaOH固体溶于水配成100 mL溶液,其密度为1.60 g/mL,小明计划用配好的NaOH溶液制取简易消毒液。回答下列问题:
(1)用量筒取小明同学所配的NaOH溶液________ mL才能与标准状况下2.24 L氯气恰好完全反应.
(2)该消毒液即市面上的“84消毒液”,小明将(2)所取体积的NaOH溶液吸收好氯气后的溶液稀释到5 L使用,稀释后溶液中c(Na+)= ___________
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员需要520 mL 2.3 mol/L的稀硫酸,拟采用98%(密度为1.84 g/cm3)的浓硫酸进行配制.
①需取用的浓硫酸的体积为________mL.
②取上述配好的硫酸溶液50 g与50 g 水混合,所得溶液的物质的量浓度________
A.等于1.15 mol/L B.小于2.30 mol/L 大于1.15 mol/L
C.小于1.15 mol/L D.大于2.30 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I一反应成I3一,并在溶液中建立如下平衡:I2+I一 ![]() I3一。通过测平衡体系中c(12)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3一。通过测平衡体系中c(12)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c (12),采用如下方法:取V1mL平衡混合溶液,用c mol/L的Na2S203溶液进行滴定(反应为I2+2Na2S203=2Nal+Na2S406),消耗V2mL的Na2S203溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用____ 做指示剂,滴定终点的现象是____。
(2)下列对该同学设计方案的分析,正确的是______填字母)。
A.方案可行。能准确测定溶液中的c (12)
B.不可行。因为I一能与Na2S203发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):

已知:①I-和I3一不溶于CC14;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作I使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是____(填名称)。试指出该操作中应注意的事项为____。(任写一条)
(4)下层液体中碘单质的物质的量浓度是________。
(5)实验测得上层溶液中c(I3一)=0.049 mol/L,结合上述有关数据,计算室温条件下反应I2+I一![]() I3一的平衡常数K= ___(用具体数据列出计算式即可)。
I3一的平衡常数K= ___(用具体数据列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )
①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55.6×107
②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2
③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低
④蒸干AlCl3溶液可得纯净的无水氯化铝
⑤常温下,等体积的pH=12的碱甲溶液和pH=11的碱乙溶液,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com