
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
选项 | A | B | C | D |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | KSCN溶液滴入FeCl3溶液中 | CO2通过装有Na2O2固体的干燥管 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 溶液变为红色 | 固体由淡黄色变为白色 |
A. A B. B C. C D. D
【答案】C
【解析】
A、NaOH溶液滴入FeSO4溶液,发生反应Fe2++2OH-=Fe(OH)2↓,因为Fe(OH)2容易被O2氧化,发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象为产生白色沉淀,迅速转变为灰绿色,最终变为红褐色沉淀,涉及氧化还原反应,A错误;
B、氯水中发生反应Cl2+H2O![]() HCl+HClO,即氯水的成份是Cl2、HCl、HClO,氯水滴入石蕊,溶液先变红,HClO具有强氧化性,能把有色物质漂白,即红色褪去,涉及氧化还原反应,B错误;
HCl+HClO,即氯水的成份是Cl2、HCl、HClO,氯水滴入石蕊,溶液先变红,HClO具有强氧化性,能把有色物质漂白,即红色褪去,涉及氧化还原反应,B错误;
C、KSCN溶液滴入FeCl3溶液中发生反应FeCl3+3KSCN=Fe(SCN)3+3KCl,溶液变为红色,没有化合价的变化,不属于氧化还原反应,C正确;
D、CO2通过装有Na2O2固体的干燥管,发生反应2CO2+2Na2O2=2Na2CO3+O2,固体由淡黄色变为白色,存在化合价的变化,属于氧化还原反应,D错误。
答案选C。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】下列数据中合理的是( )
A.用10 mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用广范pH试纸测得某溶液的pH为2.3
D.用温度计测量某溶液温度为20.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记接着问环保局长:如果玻璃酒瓶属于可回收垃圾,你知道酒瓶玻璃的主要成份
A. 2CaO·SiO2 B. 3CaO·Al2O3 C. CaO·PbO·6SiO2 D. Na2O·CaO·6SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
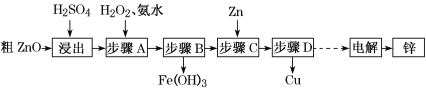
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(CB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
I.定性实验方案如下:
(1))利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因是:___________。
II.定量实验方案如下(部分装置和操作略):

(2)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为________________。
(3)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定,除去H2O2的方法是_______。
(4)步骤X滴定至终点时,消耗NaOH溶液30.00mL,该葡萄酒中SO2的含量为_____g/L。该测定结果比实际值偏高,分析原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
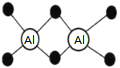
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的溶液中,可以大量共存的离子组是 ( )
A. Na+、K+、S2-、Cl-B. Al3+、Mg2+、SO42-、Cl-
C. K+、Na+、HCO3-、NO3-D. K+、Na+、SO42-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、F、Ti、Fe等都是重要的材料元素,其单质及化合物在诸多领域都有广泛的应用。
(1)在基态Ti原子中,核外存在________对自旋相反的电子,核外电子中占据的最高能层符号为___,占据该能层电子的电子云轮廓图形状为_________ 。
(2)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法不正确的是_________。
A. (N5)6(H3O)3(NH4)4Cl中含四种离子 B. N5+N5-属于共价化合物
C.每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(3)NH3分子空间结构为_______;在BF3中B原子的杂化方式为______。
(4)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-离子,则钛元素的化合价是______,配体是_____。
(5)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:____________。
(6)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c=0.469nm,则该钛晶体的密度为______g/cm3(用NA表示阿伏伽德罗常数的值,列出计算式即可)。
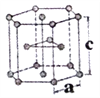
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阳极的电极反应式________;
(3)某课题组用上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净。洗涤沉淀的操作是________。
②反应①的离子方程式为______________________。
③如下图,氧化还原滴定法测定制得的Ce(OH)4产品纯度。
![]()
该产品中Ce(OH)4的质量分数为________________(保留两位有效数字)。若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度__________ (“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com