
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
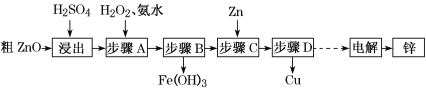
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
【答案】将粗氧化锌粉碎成细颗粒、适当增加硫酸的浓度、适当升高温度(任写一点)3.2≤pH<5.22Fe2++H2O2+2H+===2Fe3++2H2O过滤ZnO+2NaOH+H2O===Na2[Zn(OH)4] [Zn(OH)4]2-+2e-===Zn+4OH-
【解析】
(1)根据影响化学反应速率的因素,酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有将粗氧化锌粉碎成细颗粒、适当增加硫酸的浓度、适当升高温度等,故答案为:将粗氧化锌粉碎成细颗粒(或适当增加硫酸的浓度、适当升高温度等);
(2)氢氧化铁沉淀时的pH是1.48~3.2,Zn(OH)2沉淀时的pH为6.2~8.0;和Cu(OH)2沉淀时的pH为5.2~6.4,因此将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围为3.2≤pH<5.2,加入H2O2,发生过氧化氢氧化亚铁离子的反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:3.2≤pH<5.2;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)步骤C中加入锌,发生锌和硫酸铜反应生成铜和硫酸锌,从混合物中分离得到铜的方法为过滤,故答案为:过滤;
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为ZnO+2NaOH+H2O=Na2[Zn(OH)4];然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为[Zn(OH)4]2-+2e-=Zn+4OH-,故答案为:ZnO+2NaOH+H2O=Na2[Zn(OH)4];[Zn(OH)4]2-+2e-=Zn+4OH-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
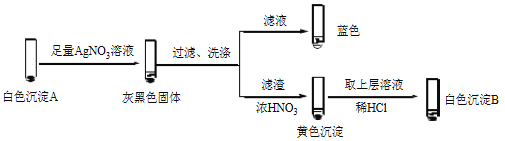
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱。甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2 ,它们之间的转化关系如下图所示(部分反应物省略),下列叙述正确的是( )

A. C、D两元素形成化合物属共价化合物
B. A、D分别与B元素形成的化合物都是大气污染物
C. C、D的简单离子均能促进水的电离
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,恒容的密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),反应过程中某一时刻测得SO2、O2SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能出现的数据是
2SO3(g),反应过程中某一时刻测得SO2、O2SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能出现的数据是
A. c(O2)=0.3mol/L B. c(SO3)+c(SO2)=0.4 mol/L
C. c(S03)=0.4 mol/L D. c(S03)+c(SO2)=0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)室温下,调节pH为5。试通过计算说明此时Al3+、Fe3+已沉淀完全,理由是_________。 “净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。

(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。1150℃时,反应的化学方程式为___________________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000-20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 |
|
|
|
键能 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A. 反应中![]() 为吸热反应
为吸热反应
B. 过程![]() 放出能量
放出能量
C. 反应中![]() ,N2与F2的总能量小于NF3的总能量
,N2与F2的总能量小于NF3的总能量
D. NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
选项 | A | B | C | D |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | KSCN溶液滴入FeCl3溶液中 | CO2通过装有Na2O2固体的干燥管 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 溶液变为红色 | 固体由淡黄色变为白色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃将相同物质的量浓度的CH3COOH和NaOH溶液混合,欲使混合液的pH=7,则CH3COOH溶液的体积V1和NaOH溶液的体积V2的关系是
A. V1=V2B. V1>V2C. V1<V2D. V1≥V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 天然气和沼气的主要成分都是甲烷,它们都属于不可再生能源
B. 煤的气化和液化均属于物理变化
C. 石油裂解的目的是为了得到更多的汽油
D. 用含糖类、淀粉比较多的农作物为原料,在催化剂作用下,经水解和细菌发酵制乙醇的过程属于生物质能的利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com