
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱。甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2 ,它们之间的转化关系如下图所示(部分反应物省略),下列叙述正确的是( )

A. C、D两元素形成化合物属共价化合物
B. A、D分别与B元素形成的化合物都是大气污染物
C. C、D的简单离子均能促进水的电离
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】(题文)下列说法正确的是
A. 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀
B. 向0.1 mol·L-1CH3COONa溶液中加入少量水,溶液中![]() 减小
减小
C. 一定温度下,增大反应2BaO2(s)![]() 2BaO(s)+O2(g)容器的体积,平衡不移动
2BaO(s)+O2(g)容器的体积,平衡不移动
D. 反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数据中合理的是( )
A.用10 mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用广范pH试纸测得某溶液的pH为2.3
D.用温度计测量某溶液温度为20.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取.收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
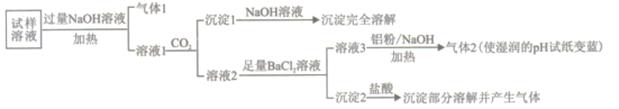
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记接着问环保局长:如果玻璃酒瓶属于可回收垃圾,你知道酒瓶玻璃的主要成份
A. 2CaO·SiO2 B. 3CaO·Al2O3 C. CaO·PbO·6SiO2 D. Na2O·CaO·6SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
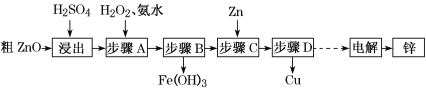
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、F、Ti、Fe等都是重要的材料元素,其单质及化合物在诸多领域都有广泛的应用。
(1)在基态Ti原子中,核外存在________对自旋相反的电子,核外电子中占据的最高能层符号为___,占据该能层电子的电子云轮廓图形状为_________ 。
(2)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法不正确的是_________。
A. (N5)6(H3O)3(NH4)4Cl中含四种离子 B. N5+N5-属于共价化合物
C.每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(3)NH3分子空间结构为_______;在BF3中B原子的杂化方式为______。
(4)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-离子,则钛元素的化合价是______,配体是_____。
(5)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:____________。
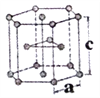
(6)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c=0.469nm,则该钛晶体的密度为______g/cm3(用NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com