
【题目】下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰B.钠原子最外层只有一个电子
C.钠有很强的还原性D.钠燃烧时生成氧化钠
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
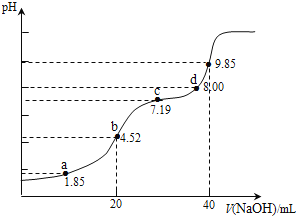
A.a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 molL-1
B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C.c点所得溶液中:c(Na+)<3c(HSO3 )
D.d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO2![]() 3CO2+N2O。下列关于N2O的说法正确的是( )
3CO2+N2O。下列关于N2O的说法正确的是( )
A. 上述反应中每生成1 mol N2O,转移的电子数为3NA
B. 等物质的量的N2O和CO2含有相等的电子数
C. N2O只具有氧化性,无还原性
D. N2O会迅速与人体血红蛋白结合,使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下微型实验装置用以验证SO2的性质,通过分析实验,下列结论表达不正确的是( )

A. a棉球褪色,验证SO2具有漂白性
B. b棉球褪色,验证SO2具有酸性氧化物的性质
C. c棉球蓝色褪去,验证SO2具有还原性
D. 只能用烧碱溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是 2Ag+2H+=2Ag++H2↑,则下列关于该装置的有关说法正确的是
A. 该装置可能是原电池,也可能是电解池
B. 该装置只能是原电池,且电解质溶液为硝酸
C. 该装置只能是电解池,且金属银为该电解池的阳极
D. 该装置只能是原电池,电解质溶液不可能是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱。甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2 ,它们之间的转化关系如下图所示(部分反应物省略),下列叙述正确的是( )

A. C、D两元素形成化合物属共价化合物
B. A、D分别与B元素形成的化合物都是大气污染物
C. C、D的简单离子均能促进水的电离
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)戊装置中冷凝管的进水口为___________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为________________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________________。
(4)如果缺少乙装置,可能产生的后果是___________________;己装置的作用是__________________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 C.溴水 d.AgNO3溶液
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38 gSnCl4,则SnCl4的产率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)室温下,调节pH为5。试通过计算说明此时Al3+、Fe3+已沉淀完全,理由是_________。 “净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。

(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。1150℃时,反应的化学方程式为___________________。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com