
【题目】已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
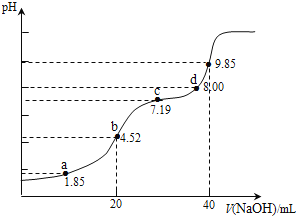
A.a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 molL-1
B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C.c点所得溶液中:c(Na+)<3c(HSO3 )
D.d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
【答案】C
【解析】
试题分析:A、用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,PH=1.85=Pa1,电离平衡常数表达式得到则c(H2SO3)=c(HSO3-),溶液体积大于20ml,a点所得溶液中:c(H2SO3)+c(SO32-)+c(HSO3-)=2c(H2SO3)+c(SO32-)<0.1 molL-1 ,故A正确;B、b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),得到:c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;C、c点pH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2OHSO3-+OH-,Kh=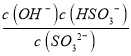 =
=![]() ,c(OH-)=
,c(OH-)=![]() ,代入计算得到:c(HSO32-)=c(SO32-),根据物料守恒,溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3 ),故C错误;D、加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1molL-1H2SO3溶液恰好反应生成Na2SO3,d点溶液中主要是Na2SO3和少量NaHSO3,溶液中离子浓度c(Na+)>c(SO32-)>c(HSO3-),故D正确;故选C。
,代入计算得到:c(HSO32-)=c(SO32-),根据物料守恒,溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3 ),故C错误;D、加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1molL-1H2SO3溶液恰好反应生成Na2SO3,d点溶液中主要是Na2SO3和少量NaHSO3,溶液中离子浓度c(Na+)>c(SO32-)>c(HSO3-),故D正确;故选C。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】若NA表示阿佛加德罗常数,下列说法正确的是:
A. 14 g 氮气中含有7NA个电子
B. 1 mol Cl2作为氧化剂得到的电子数为NA
C. 标准状况下,2. 24 L的CCl4中含有的C—Cl键数为0. 4NA
D. 常温常压下,3. 0 g含甲醛的冰醋酸中含有的原子总数为0. 4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4 kJ·mol-1
则14g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为
A.-218 kJ·mol-1 B.-109 kJ·mol-1
C.+218 kJ·mol-1 D.+109 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取四个干燥的烧瓶,分别装入标准状况下的干燥氨气、含有二分之一体积空气的氯化氢、二氧化氮和氧气(体积比为4∶1)的混合气体、二氧化氮和氧气(体积比为4∶3)的混合气体;然后分别做溶解于水的喷泉实验。实验结束后四个烧瓶中所得溶液的物质的量浓度之比为 ( )
A. 2∶1∶2∶2 B. 5∶5∶5∶4
C. 5∶5∶4∶4 D. 7∶7∶4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:
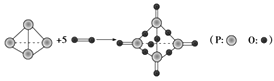
试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量_____kJ。
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
Ⅱ.化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是_________(填序号)。
A. 2FeBr2 + 3Cl2 = 2FeCl3+2Br2
B. Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C. 2H2O = 2H2↑+O2↑
D. Cu+2AgNO3 = 2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
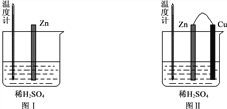
有关实验现象,下列说法正确的是:_____________(填序号)。
图Ⅰ中气泡产生在锌棒表面,Ⅱ中产生在铜棒表面
图Ⅰ和图Ⅱ的气泡均产生在锌棒表面
两图中生成气体的速率几乎一样快
图Ⅱ中产生气体的速度比Ⅰ快
温度计显示的均为室温
图Ⅱ中温度计的示数高于图Ⅰ的示数
图Ⅰ中温度计的示数高于图Ⅱ的示数
图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为____________________,一段时间后,负极增重48克,转移电子_______mol。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
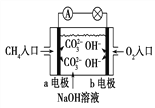
①电池的负极反应式为: ____________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )

A . Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料
(1)已知: N2(g)+O2(g)= 2NO(g) △H = +180.5kJ·mol-1
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H = -905kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为 。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
A.增大压强 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3S+6KOH===2K2S+K2SO3+3H2O中,被氧化的硫与被还原的硫的物质的量之比为( )
A. 2:1 B. 1:3 C. 3:1 D. 1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com