
【题目】在反应3S+6KOH===2K2S+K2SO3+3H2O中,被氧化的硫与被还原的硫的物质的量之比为( )
A. 2:1 B. 1:3 C. 3:1 D. 1:2
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
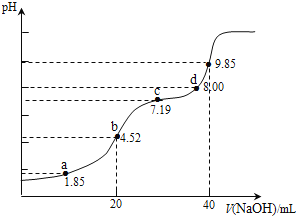
A.a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 molL-1
B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C.c点所得溶液中:c(Na+)<3c(HSO3 )
D.d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成n mol A2,同时消耗2n mol AB
B.容器内三种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验。
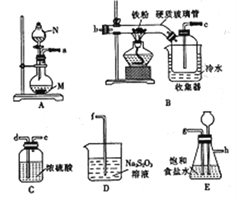
已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600 ℃的铁屑中通人氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气,
(1)仪器N的名称是____________, N中盛有浓盐酸,烧瓶M中的固体试剂___________(填化学式)。
(2)装置的连接顺序为_______→ → → → → → →d→e→f。(用小写字母表示,部分装置可以重复使用)
(3)若缺少装置E,则对本实验造成的影响是___________________________。
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中
发生反应的离子方称式为_________________________。
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质 一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
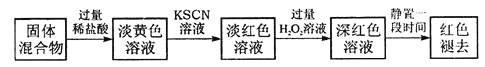
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是__________________(用离子方程式表示)。
②已知红色褪去的同时有气体生成,经检验气体为O2。该小组对红色褪去的原因进行探究。
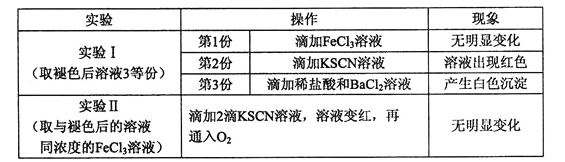
由实验Ⅰ和Ⅱ可得出的结论为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A.CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-用热的纯碱溶液清洗油污
+OH-用热的纯碱溶液清洗油污
B.SnCl2+H2O![]() Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl制备TiO2纳米粉
TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.Al3++3H2O![]() Al(OH)3(胶体)+3H+明矾净水
Al(OH)3(胶体)+3H+明矾净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+2Y(s) ![]() 2Z(g) △H=-akJ/mol,一定条件下,将1molX和2molY加入2L的恒容密闭容器中,10min后测得Y的物质的量为1.4mol。下列说法正确的是
2Z(g) △H=-akJ/mol,一定条件下,将1molX和2molY加入2L的恒容密闭容器中,10min后测得Y的物质的量为1.4mol。下列说法正确的是
A. 10min内,X的平均反应速率为0.03mol/(L·min)
B. 若容器中的气体密度不再发生变化,说明上述反应已达平衡状态
C. 10min后Z的浓度为0.7mol/L
D. 10min内,反应放出的热量为0.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾(K2CrO4)为原料用电化学法制备K2Cr2O7的装置如图,下列说法正确的是
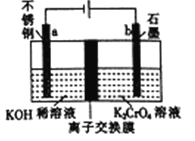
A. a极的电极反应为:2H2O+2e-=2OH-+H2↑
B. 电解过程中氢氧化钾溶液的浓度保持不变
C. b极上CrO42-发生氧化反应生成Cr2O72-
D. 电解过程中H+从右侧通过离子交换膜迁移到左侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
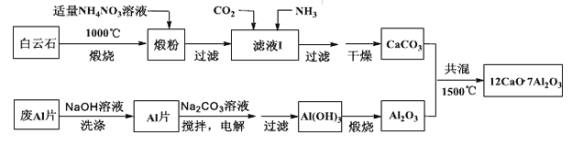
(1)煅粉主要含MgO和 ,用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶, 若溶液I中c(Mg2+)小于5×10-6mol·L-1,则溶液pH大于 (Mg(OH)2的Ksp=5×10-12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 。
(2)滤液I中的阴离子有 (忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
(5)一种可超快充电的新型铝电池,充放电时AlCl4—和Al2Cl7—两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( )
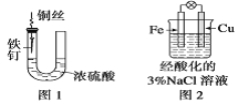

A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D、图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com