
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
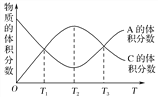
A. 该反应在T1、T3温度时达到化学平衡
B. 该反应在T2温度时达到化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
【答案】B
【解析】试题分析:T2℃之前A%变小,C%从0渐增大,而T2℃之后A%渐大,C%渐小,说明T2℃之前是反应没有达到平衡状态,而T2℃时恰好平衡,T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应。A、T1温度之后A%继续变小,C%继续增大,T3温度之后A%继续增大,C%继续减小,故T1、T3温度时未达到化学平衡,A错误;B、T2℃之前A%变小,C%从0渐增大,而T2℃之后A%渐大,C%渐小,说明T2℃时反应达到平衡状态,B正确;C、T2℃时恰好平衡,T2℃之后A%渐大,C%渐小,说明T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应,C错误;D、T2℃时恰好平衡,T2℃之后A%渐大,C%渐小,说明T2℃之后是温度升高使平衡向逆反应移动,D错误。答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有易溶强电解质的混合溶液10L,其中可能含有K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下明所示,下列说法正确的是
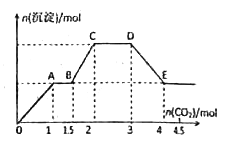
A. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
B. 肯定不存在的离子是SO42-、OH-
C. 若不能确定的离子中至少还存在着一种阳离子,则该离子的最小浓度为0.2 mol/L
D. OA段反应的离子方程式:2 AlO2-+ CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科技发展离不开化学。下列说法不正确的是( )
A.“一带一路”,丝绸制品严禁用添加蛋白酶的洗衣粉漂洗
B.“乘风破浪”,航母上的钛合金铆钉可抗海水腐蚀
C.“筑梦天宫”,火箭助推剂——液氧在工业上可通过分解氯酸钾制得
D.“直上云霄”,客机所用燃油是石油的分馏产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1molL﹣1NaOH溶液500mL,根据溶液的配制情况,回答下列问题: 
(1)配制过程中需玻璃仪器有:烧杯、量筒、胶头滴管、、 .
(2)要完成本实验应称量NaOH固体的质量是 .
(3)配制溶液时,一般可以分为以下几个步骤:①计算;②称量;③;④冷却;⑤转移;⑥;⑦定容;⑧倒转摇匀.
(4)如图装置是某同学配制此溶液时转移操作的示意图,图中的错误是 .
(5)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏低的是 . ①容量瓶不干燥,含有少量蒸馏水
②定容时俯视刻度线
③转移溶液时不慎有少量溶液洒到容量瓶外面
④定容摇匀后发现液面低于刻度线,再补加少量蒸馏水至刻度线
(6)NaOH溶液配制完成后,取100mL该溶液与100mL盐酸溶液混合,恰好完全中和,则该盐酸溶液的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c (Na+)>c(CO32-)>c(HCO3-)>c(OH-) >c(H+)
C. 常温下,pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③
D. 将CH3COONa溶液从20℃升温至30℃,溶液中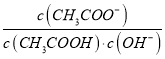 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
(1)实验室中少量的钠通常保存在 中,在实验室中取用钠的仪器是 .
(2)若将钠在空气中加热,钠会燃烧发出黄色火焰,同时生成 色的固体,写出该产物与H2O反应的化学方程式: .
(3)将金属钠投入水中,发生反应的离子方程式为
(4)该同学在实验室欲配制500mL0.1mol/L NaOH溶液. ①配制溶液时肯定不需要如图所示仪器中的(填字母),配制上述溶液还需要用到的玻璃仪器是(填仪器名称).
②根据计算,该同学应用托盘天平称取NaOH的质量为 .
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L.下列操作会引起所配浓度偏大的是 .
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.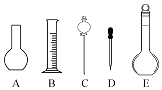
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17克NH3共有mol原子,0.1molH2S共有个氢原子;同质量的NH3和H2S中分子个数比为 . 在标准状况下,35.5g氯气的体积是 L,将其与氢气完全化合,需氢气的物质的量是mol,将生成的气体配制成1L溶液,溶质的物质的量浓度是molL﹣1 , 将此溶液取出20mL加蒸馏水制成200mL溶液,此冲稀后溶液中溶质的物质的量浓度是molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石英、焦炭为原料的部分化工流程如图所示. 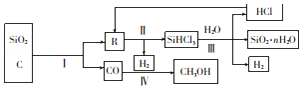
回答下列问题:
(1)反应I在工业上的作用是生产粗硅,为鉴定产品R中是否含有微量的铁单质,取少量R,用稀盐酸溶解,取上层清液后需再加入的试剂是(填字母). a.碘水 b.氯水 c.KSCN溶液 d.NaCl溶液
(2)反应Ⅱ要在干燥环境下迸行,其原因是;经冷凝得到的SiHCl3(沸点为33.0℃)中含有少量SiCl4沸点为57.6℃)和HC1(沸点为﹣84.7℃),则提纯SiHCl3的方法为 .
(3)将水蒸气通过灼热的煤粉可产生水煤气,其主要成分是CO、H2 . 工业上将水煤气液化后制得的CH3OH中含有的化学键类型为(填“离子键”或“共价键”);流程图中的反应Ⅲ为氧化还原反应,其化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com