
| A. | ①②③⑤ | B. | ②③⑤ | C. | ②③ | D. | 全部 |
分析 ①酸性氧化物是能和碱反应生成盐和水的氧化物;
②化合反应是由两种或两种以上的物质生成一种物质的反应;
③碘溶于酒精,得溶液,饱和氯化铁滴入沸水中,得氢氧化铁胶体;
④金属和非金属元素形成的化合物不一定是离子化合物;
⑤单质既不是电解质也不是非电解质.
解答 解:①酸性氧化物是能和碱反应生成盐和水的氧化物,CO、NO不能和碱反应属于不成盐氧化物,不是酸性氧化物,故①错误;
②化合反应是由两种或两种以上的物质生成一种物质的反应,Ca(HCO3)2可由化合反应CaCO3+CO2+H2O=2Ca(HCO3)2制得,SO3可由化合反应2SO2+O2=2SO3制得,FeCl2可由化合反应2FeCl3+Fe=3FeCl2制得,故②正确;
③碘溶于酒精得溶液,饱和氯化铁滴入沸水中,得氢氧化铁胶体,故③正确;
④金属和非金属元素形成的化合物不一定是离子化合物,如AlCl3是共价化合物,故④错误;
⑤单质既不是电解质也不是非电解质,故氯气不是非电解质,故⑤错误.
故选C.
点评 本题考查了酸性氧化物和非金属氧化物的关系、溶液和胶体的制得以及离子化合物的概念,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 过年时尽量少燃放烟花爆竹 | |
| B. | PM2.5是形成沙尘暴天气的主要因素 | |
| C. | 其颗粒小,在大气中的停留时间长、输送距离远,因而对人体健康影响更大 | |
| D. | 香烟烟雾颗粒的直径大多在0.1至1.0微米,所以公共场所禁烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙酸 | 乙醇 | |
| 熔点/℃ | 16.6 | -114.3 |
| 沸点/℃ | 117.9 | 78.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27g,第二次称量沉淀质量为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
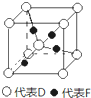 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.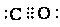 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe | B. | Cu | C. | Fe 和 Cu | D. | Cu 和 Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
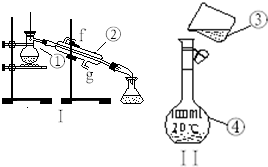 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图Ⅰ为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图Ⅰ为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16种 | B. | 2种 | C. | 32种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 键能 | 键能 | |||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | ||
| S-S | 255 | H-S | 339 | C-F | 427 | ||
| C-Cl | 330 | C-I | 218 | H-F | 568 | ||
| C-O | 351 | H-O | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com